ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Kontaktoverfølsomhed (CHS) er en murin eksperimentel model af allergisk kontaktdermatitis (ACD). CHS er baseret på sensibilisering med reaktiv hapten ved at male den barberede hud i brystet og maven med en efterfølgende ørehududfordring med en fortyndet hapten, hvilket forårsager en hævelsesreaktion, der vurderes på forskellige måder.
Abstract
Kontaktoverfølsomhed (CHS) er en eksperimentel model af allergisk kontaktdermatitis (ACD), der kan undersøges hos mus. Denne undersøgelse har til formål at præsentere en objektiv laboratoriemetode, der kan hjælpe med at studere CHS-reaktionen hos mus, som kan måles og kvantificeres ved forskellige tests. For at inducere CHS blev mus på dag "0" sensibiliseret på et tidligere barberet sted ved abdominal hudmaling med hapten 2,4,6-trinitrochlorbenzen (TNCB) i en acetone-ethanolblanding, mens negative kontrolmus blev sham sensibiliseret med køretøjs alene-acetone-ethanolblanding. På dag "4" blev baseline-øretykkelsen målt med et mikrometer før udløsning af CHS (udfordring) ved at male begge ører med fortyndet TNCB både i test- og kontrolgrupperne. Efter 24 timer blev øre hævelsen målt med et mikrometer. CHS er et eksempel på et T-cellemedieret immunrespons, der forårsager hævelse i betændt væv, der topper 24 timer efter hududfordringen med samme hapten. En stigning i øreødem korreleret med forøget ørevægt, myeloperoxidase (MPO) aktivitet, proinflammatorisk cytokinkoncentration i øreekstrakterne, øget fortykkelse af den edematøse dermis i den histologiske undersøgelse og øre vaskulær permeabilitet. Der var også en stigning i koncentrationen af TNP-specifikke IgG1-antistoffer i sera i testgruppen sammenlignet med kontrolmusene. Derudover kan CHS med succes overføres med CHS-effektorceller opnået fra donorer, der tidligere var sensibiliseret med TNCB. CHS-effektorcellerne blev administreret intravenøst i naive recipientmus, som efterfølgende blev udfordret med den samme fortyndede hapten. Øre hævelse blev målt med en mikrometer 24 timer senere.
Introduction
Allergisk kontaktdermatitis (ACD) er en almindelig hudinflammatorisk sygdom i industrialiserede lande forårsaget af en type IV overfølsomhedsreaktion som følge af eksponering for kemikalier med lav molekylvægt kaldet haptens. De stoffer, der forårsager kontaktsensibilisering hos mennesker, omfatter tungmetalioner (krom, nikkel, jern, kobolt), terpentin, duftstoffer, farvestoffer og konserveringsmidler, der findes i kosmetik (f.eks. p-phenylendiamin), nogle lægemidler (f.eks. Neomycin, benzocain), β-lactamantibiotika (dvs. penicillin), kemikalier fremstillet af planter (pentadecacatechol, et stof, der findes i poison ivy) samt hydroquinon, der anvendes i den fotografiske industri 1,2 . ACD etiologiske midler er meget høje, da over 100.000 kemikalier anvendes i industrien alene, og 2.000 nye syntetiseres hvert år. Til dato er der identificeret mere end 3.700 molekyler, der kan være kontakt haptens / allergener3. Kontaktoverfølsomhedsreaktionen (CHS) er en eksperimentel model af ACD, der kan studeres hos mus, marsvin og rotter og kan induceres ved topisk hudpåføring af reaktive kemiske haptens opløst i organiske opløsningsmidler 4,5,6. Denne undersøgelse har til formål at beskrive en objektiv laboratoriemetode, der kan hjælpe med at studere CHS-reaktionen hos mus, som kan måles og kvantificeres ved forskellige tests.
CHS består af sensibiliseringsfaser (induktion) og effektorfaser (udfordring). I dyremodeller binder haptens først kovalent til proteiner i kroppen for at skabe neoantigener. Under sensibiliseringsfasen fremmer aktiverede keratinocytter migration og modning af huddendritceller (sDC'er) ved at producere proinflammatoriske cytokiner-tumornekrosefaktor α (TNF-α) og interleukin 1β (IL-1β)7. Epidermale Langerhans-celler (LC'er) præsenterer antigener under CHS-induktions- og effektorfaserne8. LC'er udsat for hapten under sensibilisering fremmer induktion af både regulatoriske og effektorceller9. Stigende beviser fra flere undersøgelser tyder på, at CHS-reaktioner kan medieres af enten CD4 + MHC klasse II-begrænsede Th1-celler, lokalt frigive interferon-γ (IFN-γ) for at anvende et karakteristisk inflammatorisk infiltrat, CD8 + MHC klasse I-begrænsede Tc1 lymfocytter, der også kan frigive IFN-γ men for det meste mediere cytotoksisk skade på keratinocytter, og nu også interleukin 17 (IL-17) -producerende Th17-celler10, 11.
Der er udviklet flere forskellige CHS-modeller, der anvender forskellige arter1 2,13,14 og haptens (en detaljeret sammenligning af forskellige haptens, opløsningsmidler og anvendelsestidspunkt er opsummeret i tabel 1). Musen, en ofte anvendt laboratorieart, giver et par fordele ved at studere CHS. Der er flere stammer, knockouts (KO) og transgene dyr blandt mus sammenlignet med andre arter, hvilket gør dem til et meget attraktivt dyr15. Derudover kræver CHS-modellen mange dyr, og mus er mere økonomiske her. Dyremodeller efterligner ikke ACD i alle aspekter; især viser de skorpedannelse og afskalning, hvilket ikke er almindeligt for mennesker16,17. Funktionerne ved kronisk sygdom er udfordrende at reproducere, hovedsageligt fordi den beskrevne model ikke antager anvendelse af hapten i lang tid. Det er imidlertid blevet bekræftet her, at mange af de væsentlige aspekter af ACD gengives. Det har også vist sig, at disse træk som hos mennesker er forbundet med lokale allergiske reaktioner. Valget af hapten, dets opløsningsmiddel og dets anvendelse, der er skitseret i denne protokol, blev dikteret af det faktum, at resultaterne er blevet bekræftet af adskillige in vitro-tests, og at det blev testet og modificeret i laboratoriet i mange år, indtil den nuværende version blev etableret. Murine-modeller giver mulighed for analyse af celleundergrupper eller cytokiner, der er involveret i udviklingen af ACD og er afgørende for prækliniske vurderinger af nye behandlinger.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle eksperimenter, der præsenteres i denne artikel, blev udført i henhold til retningslinjerne fra 1. lokale etiske udvalg for dyreforsøg i Krakow. Alle de beskrevne procedurer blev udført i henhold til de lokale anbefalinger, især vedrørende anvendelse af ketamin / xylazin som bedøvelsesmiddel, brug af begge sider af ørerne til at påføre stoffet / hapten, afskære øret og samle blod ved fjernelse af øjenæble. BALB/c (haplotype H-2d), CBA/J (H-2k) og C57BL/6 (H-2b) han- og hunmus, 6-12 uger gamle, blev anvendt til denne undersøgelse (se Materialetabel). For statistisk signifikans er det bedst, hvis hver gruppe mus består af 10-12 dyr.
1. Forberedelse af dyr
- Rengør operationsbordet med en 70% ethanolopløsning før og efter alle procedurer. Hvis du bruger mus, der kræver sterile forhold, skal du udføre alle operationer i et biosikkerhedsskab.
2. Mærkning af mus til identifikation
- Mærk musene ved at barbere huden med et barberblad: #0 - umærket, #2 - på højre forpote, #3 - på højre side, #4 - på højre bagpote, #5 - ved bunden af halen, #6 - på venstre bagpote, #7 - på venstre side, #8 - på venstre forpote.
BEMÆRK: På grund af den inducerede reaktion kan mus ikke mærkes klassisk ved ørestansning eller mærkning. Musene blev ikke bedøvet under mærkning.
3. Induktion af CHS
BEMÆRK: Denne procedure er afbildet i figur 1.
- Udfør sensibiliseringen (induktion) ved at følge nedenstående trin.
- På dag "0" barberes mus på brystet og maven (firkantet 2 cm x 2 cm) ved at påføre grå sæbe med vand og barbere sig med et barberblad.
BEMÆRK: Før du påfører hapten, skal du vente i 6 timer, så huden ikke irriteres. - 5% hapten: 2,4,6-trinitrochlorbenzen (TNCB, se materialetabel) fremstilles i en acetone-ethanolblanding (forhold 1:3) eller køretøjet alene (acetone-ethanol). Forbered opløsninger lige før brug i et hætteglas og beskyt det mod lys ved at dække hætteglasset med aluminiumsfolie.
- Samme dag sensibiliseres musene ved at påføre 150 μL 5% hapten på det tidligere barberede sted. I gruppen af kontrolmus skal du anvende køretøjet alene for at vurdere den ikke-specifikke inflammatoriske reaktion. Før du sætter dyret tilbage i buret, skal du vente i 30 s og lade hapten tørre.
FORSIGTIG: Brug handsker; TNCB forårsager en alvorlig allergisk reaktion hos de fleste mennesker.
- På dag "0" barberes mus på brystet og maven (firkantet 2 cm x 2 cm) ved at påføre grå sæbe med vand og barbere sig med et barberblad.
- Udfør måling af udløsning (udfordring) og øre hævelse.
- På dag "4" forberedes 0,4% hapten: TNCB i en acetone-ethanolblanding (forhold 1: 1). Forbered opløsningen lige før brug i et hætteglas og beskyt den mod lys ved at dække hætteglasset med aluminiumsfolie.
- Bedøv musene med en intraperitoneal (i.p.) injektion af en blanding af ketamin (90-120 mg / kg) og xylazin (5-10 mg / kg) (se materialetabel) til dyb anæstesi. Sørg for, at musen er fuldt bedøvet i mindst 5 minutter ved tåspids.
- Mål øretykkelsen (0 timers måling, baseline) med et mikrometer (se Materialetabel) af en observatør, der ikke er klar over de eksperimentelle grupper.
- Påfør 10 μL 0,4% hapten på begge sider af ørerne i begge grupper (test og kontrol). Før du sætter dyret tilbage i buret, skal du vente i 30 s og lade hapten tørre.
- På dag "5", 24 timer efter hapten påføring, gentages trin 3.2.2-3.2.3 for 24 timers målingen.
- Evaluer CHS-responsen ved at beregne forskellen i aurikeltykkelse før og efter udfordringen med hapten: 24 h øretykkelse (μm) - 0 h øretykkelse (μm). Tæl hvert øre som en separat måling. Derefter udtrykkes ørehævelsen i mikrometer (μm) ± standardfejl i middelværdien (SEM) (tabel 2, figur 3).
4. Ørebiopsier
- Umiddelbart efter 24 timers måling af øretykkelse (når musen stadig er under dyb anæstesi), skal du afskære ørerne så tæt på kraniet som muligt med en saks. Saml biopsierne fra den distale side af ørerne ved at lave en 6 mm diameter punch ved hjælp af en biopsi punch (se Tabel over materialer).
- Ørevægten måles (trin 4.2), og der udføres desuden en af følgende test på samme ørebiopsi: myeloperoxidase (MPO) assay (trin 4.3) eller in vitro-måling af cytokinkoncentrationen i øreekstrakterne (f.eks. IFN-γ, IL-17A, TNF-α [trin 4.4]).
BEMÆRK: Skær ørerne før blodindsamling. Efter denne procedure skal musene aflives (f.eks. ved cervikal dislokation).
- Ørevægten måles (trin 4.2), og der udføres desuden en af følgende test på samme ørebiopsi: myeloperoxidase (MPO) assay (trin 4.3) eller in vitro-måling af cytokinkoncentrationen i øreekstrakterne (f.eks. IFN-γ, IL-17A, TNF-α [trin 4.4]).
- Mål vægten af hver ørebiopsi på den analytiske balance og udtrykke den i milligram (mg) (figur 4).
- Udfør et MPO-assay ved at følge nedenstående trin.
- Homogeniseringsbufferen fremstilles ved at opløse 0,5 % hexadecyltrimethylammoniumbromid i 50 mmol phosphoratbuffer KH2PO4/Na2HPO4 og justere pH til 6,0 (anvendes ved stuetemperatur, RT).
- Homogeniser biopsierne i 2 ml mikrocentrifugerør med 500 μL forberedt buffer i 10 minutter ved hjælp af en homogenisator med 5 mm diameter rustfrit stålperler (tilsæt to perler / hætteglas) (se Materialetabel). Derefter afkøles prøven i 15 minutter ved 4 °C og homogeniseres i yderligere 10 minutter.
BEMÆRK: Microcentrifuge rør har en rund bund, så perlerne let kan bevæge sig. - Homogenaterne fryses ved −20 °C i 30 min. Optø og hvirvel (sørg for, at prøverne optøes). Gentag denne procedure 3x.
- Homogenaterne centrifugeres ved 3.000 x g i 30 minutter ved 4 °C. Høst supernatanterne med en pipette. Mpo-aktiviteten udtrykkes i enheder (U) pr. 1 mg protein.
BEMÆRK: Protokollen kan sættes på pause her. Prøverne er stabile ved −20 °C i 3 måneder. - For at måle MPO-aktivitet udføres en enzymatisk reaktion ved at blande 20 μL supernatant og 200 μL MPO-substrat (0,167 mg / ml ortho-diansindihydrochlorid i 50 mmol KH2PO4 / Na2HPO4-buffer med 5 x 10-4% H202) og tilsættes til 96-brønd fladbundede plader. Inkuber pladerne i 20 minutter ved RT.
- Standardkurven forberedes ved anvendelse af 20 μL af MPO-standarden i koncentrationer fra 0,008 U op til 0,5 U i 200 μL af MPO-substratet. Forbered blindprøven med MPO-substratet alene.
FORSIGTIG: Brug en maske, mens du arbejder med ortho-dianisindihydrochlorid.
BEMÆRK: Pladerne skal være lavet af polypropylen, som har en lavere bindingskapacitet, så proteiner eller DNA ikke binder. - Mål den optiske densitet (OD) ved en bølgelængde på λ = 460 nm. Den enzymatiske reaktion er stabil i 10 minutter. Aflæs MPO-aktiviteten i testede prøver fra standardkurven.
- For at måle proteinkoncentrationen skal du bruge 20 μL af supernatanten, udføre en test med et bicinchoninsyresæt til proteinbestemmelse (se materialetabel) og måle OD ved λ = 562 nm (figur 5).
- Udfør in vitro-måling af cytokiner i øreekstraktet.
- Homogeniser ørebiopsierne ved RT i 2 ml mikrocentrifugerør med 500 μL vævsproteinekstraktionsreagens (T-PER) i 10 minutter ved hjælp af en homogenisator med 5 mm diameter rustfrit stålperler (tilsæt to perler / hætteglas). Derefter afkøles prøven i 15 minutter ved 4 °C og homogeniseres i yderligere 10 minutter.
BEMÆRK: Microcentrifuge rør har en rund bund, så perlerne let kan bevæge sig. - Homogenaterne centrifugeres ved 3.000 x g i 30 minutter ved 4 °C.
BEMÆRK: Protokollen kan sættes på pause her. Prøverne er stabile ved -80 °C i 6 måneder. - Vurder cytokinniveauerne ved hjælp af et kommercielt tilgængeligt ELISA-sæt (f.eks. IFN-γ) (se materialetabel) efter producentens anvisninger (figur 6).
- Homogeniser ørebiopsierne ved RT i 2 ml mikrocentrifugerør med 500 μL vævsproteinekstraktionsreagens (T-PER) i 10 minutter ved hjælp af en homogenisator med 5 mm diameter rustfrit stålperler (tilsæt to perler / hætteglas). Derefter afkøles prøven i 15 minutter ved 4 °C og homogeniseres i yderligere 10 minutter.
5. Histologi af ørevæv
- Umiddelbart efter 24 timers måling af øretykkelse, når musen stadig er dybt bedøvet, afskæres ørerne så tæt på kraniet som muligt med saksen (trin 4.1).
BEMÆRK: Efter denne procedure skal musene aflives (f.eks. ved cervikal dislokation). - Udfør paraffinindlejring af vævsblokkene ved at følge nedenstående trin.
- Umiddelbart efter fjernelse placeres øret i ~ 10 ml 10% formalin i 24 timer.
- Placer ørerne i en vævsbehandlingskassette. Sæt kassetterne i en automatiseret processor (se materialetabel) til dehydreringscyklusser (alkohol 70%, 90%, 100%, 30 minutter hver ved RT), rydningscyklusser (xylen 3x, 30 minutter hver ved RT) og voksinfiltrationscyklusser (paraffin 3x, 30 minutter hver ved 56 ° C).
- Fjern kassetterne fra den automatiserede processor, og hold fast i varmepladen, indtil det er nødvendigt. Fyld voksformen med varm voks (fra dispenseren).
- Fjern sektionerne fra kassetten med opvarmede tang og læg dem i formen; Placer derefter kassettebasen på toppen af formen og fyld derefter med mere voks. Anbring det i kølet vand på en kold plade i 30 minutter, så paraffinen størkner og danner en blok indeholdende prøven.
- Brug en roterende mikrotom (se Materialetabel) til at skære sektioner ~ 5 μm tykke. Flyd sektionerne i et varmt bad for at flade dem. Tag sektionerne op på et glasmikroskopglas. Lad dem tørre ved RT for at sikre, at sektionerne klæber til diaset.
BEMÆRK: Brug dias, der eliminerer behovet for at påføre klæbende materialer eller proteinbelægninger for at forhindre tab af vævssektioner under farvning.
- Udfør hæmatoxylin og eosin (H&E) farvning.
- Forbered 17 farvningsretter med følgende: xylen (fire retter), 100% ethanol (absolut alkohol) (fire retter), 90% ethanol, 80% ethanol, 70% ethanol, 50% ethanol, PBS (tre retter), hæmatoxylinopløsning, eosinopløsning. Overfør diasene fra en skål til den næste i henhold til nedenstående trin, og udfør alt på RT.
BEMÆRK: Proceduren i hver skål kan gentages ca. 10x (f.eks. Hvis der anvendes en skål med 20 dias, kan der laves 200 pletter uden at ændre væskerne). - Deparaffiniser sektionerne ved inkubation ved 65 ° C i 30 minutter i inkubatoren. Dyp diasene i xylen i 30 min. Gentag 1x i ny xylen i 30 min.
- Dyp gliderne i 100% ethanol i 5 min. Gentag 1x i ny 100% ethanol i 5 min. Nedsænk diasene i ethanolrækken, 90%, 80%, 70% og 50% i 2 minutter i hver fortynding.
- Nedsænk rutsjebanerne i fosfatbufferet saltvand (PBS) i 5 min. Tør overskydende væske væk omkring vævet og bagsiden af dias.
- Pletter sektionerne i hæmatoxylinopløsning (se materialetabel) i 7-8 min. Vask i rindende vand i 30 s fra bagsiden for ikke at beskadige sektionerne. Trin 5.3.4 gentages.
- Pletter sektionerne med eosinopløsning (se materialetabel) i 30 s. Der vaskes som nævnt i trin 5.3.5, og trin 5.3.4 gentages.
- Nedsænk rutsjebanerne i 100 % ethanol (absolut alkohol) i 2 min. Gentag 1x i ny 100% ethanol i 2 min.
- Dyp diasene i xylen i 5 min. Gentag 1x i ny xylen i 5 min.
- Lad sektionerne lufttørre i 15 minutter ved RT. Tilføj en dråbe monteringsmedium (se Materialetabel) på en dækslip, og placer den derefter øverst på sektionen.
- Forbered 17 farvningsretter med følgende: xylen (fire retter), 100% ethanol (absolut alkohol) (fire retter), 90% ethanol, 80% ethanol, 70% ethanol, 50% ethanol, PBS (tre retter), hæmatoxylinopløsning, eosinopløsning. Overfør diasene fra en skål til den næste i henhold til nedenstående trin, og udfør alt på RT.
- Undersøg sektionen under et lysmikroskop under en forstørrelse på 20x eller 40x, og tag billeder (figur 7).
6. Vaskulær permeabilitetstest
BEMÆRK: Alternativt til øretykkelsesmåling kan der udføres en vaskulær permeabilitetstest.
- Sensibiliser mus på dag "0" (trin 3.1.1-3.1.3), og bedøv derefter musene på dag "4" (trin 3.2.2) og påfør hapten direkte på ørerne (trin 3.2.4), idet 0 timers øremåling udelades.
- Ved 23 timer efter udfordring bedøves musene (trin 3.2.2).
- Intravenøst (i.v.) 8,3 μL/g legemsvægt af 1% Evans blåt farvestof (se materialetabel) i Dulbecco's Phosphate-Buffered Saline (DPBS).
- Bedøve musene igen-dyb anæstesi (trin 3.2.2)-1 time efter Evans blå injektion.
- Der indsamles ørebiopsier (trin 4.1).
BEMÆRK: Efter denne procedure skal musene aflives (f.eks. ved cervikal dislokation). - Farvestoffet ekstraheres fra vævet, læg øreslag i rørene indeholdende 1 ml formamid, og inkuberes ved 37 °C i atmosfæren på 5% CO2 i 18 timer.
- Biopsierne centrifugeres ved 3.000 x g i 3 min ved RT. Saml supernatanterne med en pipette.
- Od måles ved en bølgelængde på λ = 565 nm i 96-brønds fladbundede plader mod et emne indeholdende formamid. Farven er stabil i 24 timer. Aflæs koncentrationen af testprøverne fra standardkurven (der anvendes koncentrationer af Evansblå fra 0,2-30 μg farvestof/ml formamid) (figur 8).
BEMÆRK: Pladerne skal være lavet af polypropylen, som har en lavere bindingskapacitet, så proteiner eller DNA ikke binder.
7. Serumindsamling og anti-TNP immunoglobulin (IgG1) antistofmåling
- Efter indsamling af ørebiopsier (trin 4.1), når musen stadig er under dyb anæstesi, skal du fjerne øjeæblet med en pincet, lægge et let tryk på musen og samle blod fra retro-orbital sinus i røret (hætteglas med gel til opnåelse af serum, se Materialetabel). En alternativ metode til indsamling af blod kan være at punktere hjertet med en sprøjte og samle blodet.
BEMÆRK: Blodet skal opsamles efter fjernelse af ørerne. Den samme blødningsmetode skal anvendes i en hel undersøgelse på grund af potentielle forskelle i blodparametre18. Efter denne procedure skal mus aflives (f.eks. Ved cervikal dislokation). - Vend mindst 6x, vent 30 min på, at blodet størkner, og centrifuger derefter ved 1.300-2.000 x g i 10 minutter ved RT.
BEMÆRK: Protokollen kan sættes på pause her. Prøven er stabil ved -20 °C i 6 måneder. - Overtræk en fladbundet 96-brøndplade med 50 μL bovint serumalbumin konjugeret med 2,4,6-trinitrophenyl (TNP-BSA) opløst i DPBS ved en samordning på 10 μg/ml. Derefter belægges den anden plade med bovint serumalbumin (BSA) alene opløst i DPBS (baggrund) i en koncentration på 10 μg/ml. Inkuberes natten over ved 4 °C.
BEMÆRK: Museserum indeholder antistoffer (Abs) mod BSA, så prøverne skal testes på begge plader, og derefter skal der foretages en beregning (OD TNP-BSA - OD BSA). - Pladerne vaskes med 300 μL DPBS indeholdende 0,05% Tween 20. Gentag 3x.
- Der fremstilles assay fortyndingsmiddel (AD): DPBS indeholdende 1% BSA. Brøndene blokeres med AD i 1 time ved RT. Vask igen (trin 7.4).
- Forbered en intern standard (iSTD): Sensibiliser musene med TNCB (trin 3.1.1-3.1.3), og 10 dage efter sensibilisering indsamles og polles serum fra alle donorer (trin 7.1 og trin 7.2).
- Til pladen tilsættes 50 μL graduerede koncentrationer af iSTD fortyndet med AD til fremstilling af standardkurven (beskrevet i tabel 3). Til pladen tilsættes 50 μL serumprøver. Hver prøve og standardkurve testes på begge plader (TNP-BSA og BSA belagt). Der inkuberes i 2 timer ved RT. Pladerne vaskes (trin 7.4).
- Der tilsættes 50 μL biotinyleret antimusE IgG1 monoklonalt antistof (mAb, se Materialetabel) fortyndet 1:250 med AD, og der inkuberes i 1 time ved RT. Vask igen (trin 7.4).
- Der tilsættes 50 μL peberrodsperoxidase streptavidin (HRD streptavidin, se Materialetabel) fortyndet 1:2000 med AD, og der inkuberes i 30 minutter ved RT i mørke. Pladen vaskes (trin 7.4).
- Der tilsættes 50 μL TMB-substrat (se materialetabel) og inkuberes i 30 min ved RT i mørke.
- Stop den enzymatiske reaktion ved at tilsætte 25 μL 1 MH2SO4; reaktionen er stabil i 30 min.
- Od måles ved en bølgelængde på λ = 450 nm og en baggrund på 570 nm (baggrunden skal trækkes fra hver 450 nm måling). Når du præsenterer resultaterne, skal du trække BSA-målingerne fra TNP-BSA for prøver og standardkurven. Beregn derefter enheden (U) af antistoffer i henhold til standardkurven (figur 9).
8. Adoptivoverførsel af CHS-effektorcellerne
BEMÆRK: Denne procedure er afbildet i figur 2.
- Donorer (i forholdet mellem en donor:1 modtager): Sensibiliser mus med TNCB på dag "0" (trin 3.1.1-3.1.3).
- På dag "4" bedøves den musedybe anæstesi (trin 3.2.2).
- Isoler med tang de aksillære og inguinale lymfeknuder (ALN'er) og milt (SPL'er). Saml ALN'erne i et hætteglas og SPL'erne i et andet.
BEMÆRK: Der er en aksillær lymfeknude bag brystmusklen i hver axilla. En lyske lymfeknude i hofteregionen ligger ved siden af tre blodkar. Milten er placeret på venstre side af kroppen bag tarm og mave19. Arbejd med sterile værktøjer i et biosikkerhedsskab for at opretholde sterile forhold. Efter denne procedure skal musene aflives (f.eks. ved cervikal dislokation). - Mos væv mellem de frostede ender af to mikroskop dias. Før cellesuspensionen gennem en cellesi med en porestørrelse på 70 μm (se Materialetabel).
- Cellerne vaskes med DPBS suppleret med 1% føtalt bovint serum (FBS). Centrifuger ved 300 x g i 10 minutter ved 4 °C. Dekanter supernatanten og resuspender den resterende cellepellet i 1-5,0 ml DPBS.
- Tæl de levende celler ved hjælp af et hæmocytometer20 med Trypan blå, og bland 10 μL af cellesuspensionen med 90-990 μL (afhængigt af cellenummeret) trypanblå. Tag hensyn til fortyndingen ved beregning af cellenummeret (10x-100x).
- Forbered en blanding af ALN'er og SPL'er (forhold 1: 1): 8,0 x 106 op til 7,0 x 107 / mus i 200 μL DPBS.
- Modtagere (naive syngenemus): Bedøver naive recipientmus (trin 3.2.2) og injicerer i.v. med en forberedt blanding af CHS-effektorcellerne (trin 8.7). I kontrolgruppen af mus må du ikke injicere nogen celler.
- Øretykkelsen måles før (0 h) og efter (24 timer) belastningen (trin 3.2.1-3.2.6) (figur 10).
- Derudover udføres test på isolerede CHS-effektorceller (f.eks. Cellefænotypning eller måling af producerede cytokiner af CHS-effektorcellerne ved flowcytometri). Cellekulturer kan også etableres, og CHS-effektorcellernes evne til at proliferere i nærvær af antigenet eller mængden af udskillede cytokiner i kultursupernatanterne kan vurderes 21,22 (data ikke præsenteret).
BEMÆRK: Udførelse af yderligere tests kræver tilsvarende flere celledonorer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Til CHS-induktion blev dyrene sensibiliseret via hudmaling (abdominal) med 150 μL 5% TNCB eller sham sensibiliseret med køretøjet alene. På dag "4" blev ørehævelsesresponserne i begge ører induceret ved kontaktmaling (udfordring) med 10 μL 0,4% TNCB hos begge mus, der tidligere var i kontakt med TNCB (testgruppe) og kontrolgruppemusene (sham sensibiliseret). De præsenterede data viser, at musene sensibiliserede med TNCB og udfordrede 4 dage senere udviklede signifikant øget øre hævelse sammenlignet med de sham-sensibiliserede, der ligeledes blev udfordret (figur 3, tabel 2, test vs. kontrolgruppe). Ørehævelsesresultaterne blev fuldstændigt valideret i yderligere undersøgelser, hvilket fremhævede, at en stigning i øreødem bestemt med et mikrometer aftalt med forøget ørevægt (figur 4), MPO-aktivitet (figur 5), IFN-γ koncentration i øreekstrakterne (figur 6), øget fortykkelse af den edematøse dermis i den histologiske undersøgelse (figur 7) og øre vaskulær permeabilitet (figur 8). ). En stigning i koncentrationen af TNP-specifikke IgG1-antistoffer blev også fundet i sera hos testmusene sammenlignet med kontroldyrene (figur 9).
Som et eksempel på T-cellemedieret immunrespons kan CHS også overføres til naive syngeneiske modtagermus. Donorer blev sensibiliseret ved TNCB-applikation, og efterfølgende blev CHS-effektorcellerne administreret i.v. i de naive modtagermus, som blev udfordret med hapten og testet for CHS 24 timer senere (figur 10). De dyr, der modtog CHS-effektorcellerne fra donorer, der tidligere var sensibiliseret med TNCB, viste signifikant øget ørehævelse sammenlignet med dyr, der kun blev udfordret (modtog ingen celler).
CHS-reaktionen har en kompleks mekanisme og involverer forskellige celler. Antigenpræsentation og T / B-celleaktivering forekommer i de perifere lymfeorganer (f.eks. ALN'er og SPL). Det blev fastslået, at CHS-effektorceller udtømt for CD4+, men ikke CD8+ -celler før adoptiv celleoverførsel resulterede i fravær af CHS-reaktionen hos recipientmusene. Disse celler viste sig at være positive for IFN-γ (T-box transkriptionsfaktor TBX21, Tbet+) og IL-17A (retinsyrereceptorrelateret forældreløs nuklear receptor gamma, RORγT+) (supplerende figur 1).
De præsenterede resultater fra de repræsentative forsøg blev udført på C57BL/6 og CBA/J han- og hunmus i 8-12 ugers alderen. Efter 3R-reglerne for anvendelse af dyr23, især reduktion, i forbindelse med denne artikel, vises resultaterne af forsøg på små grupper af dyr. Data i graferne er vist som middelværdi ± SEM. Statistisk signifikans blev sat til p < 0,05. Graferne blev tegnet ved hjælp af Prism-software (se Materialetabel).

Figur 1: Induktion af CHS. Sensibilisering, udfordring og øremåling. Forkortelser: CHS = kontaktoverfølsomhedsreaktion; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at se en større version af denne figur.

Figur 2: Adoptivoverførsel af CHS-effektorcellerne. Forkortelser: ALN 'er = aksillære og inguinale lymfeknuder; CHS = kontaktoverfølsomhedsreaktion; i.v. = intravenøst; SPL 'er = milt; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at se en større version af denne figur.

Figur 3: Repræsentativ evaluering af CHS til TNCB ved måling af øre hævelse med et mikrometer. Mus blev TNCB (testgruppe) eller sham (kontrolgruppe) sensibiliseret og efterfølgende udfordret. Tykkelsen af auricleen blev målt før og efter udfordringen, og forskelle i ørehævelse blev beregnet ved at trække øretykkelsen på 0 timer (μm) fra øretykkelsen på 24 timer (μm). Hævelse af øret blev udtrykt som gennemsnitlig ± SEM, ****p < 0,0001, n = 10 mus/gruppe (data fra tabel 2). Forkortelser: CHS = kontaktoverfølsomhedsreaktion; SEM = standardfejl i middelværdien; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at se en større version af denne figur.

Figur 4: Repræsentativ evaluering af CHS ved måling af ørevægt. Ørevægt er en af de parametre, der svarer til øre hævelse. Mus blev TNCB (testgruppe) eller sham (kontrolgruppe) sensibiliseret og efterfølgende udfordret. 24 timer efter udfordringen blev der taget slag med en diameter på 6 mm fra de fjernede ører. Slagene blev vejet på en analytisk laboratoriebalance. Ørevægt blev udtrykt i milligram (mg) som middel ± SEM, ***p < 0,001, n = 10 mus/gruppe. Forkortelser: CHS = kontaktoverfølsomhedsreaktion; SEM = standardfejl i middelværdien; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at se en større version af denne figur.

Figur 5: Repræsentativ evaluering af MPO-aktivitet. Øget MPO-aktivitet i vævsekstrakter korrelerer med ørebetændelse. TNCB-sensibiliserede mus (testgruppe) og skamfølsomme mus (kontrolgruppe) blev udfordret. Ved 24 timer efter udfordringen blev ørerne fjernet, og ørets slag med en diameter på 6 mm blev ekstraheret og behandlet. MPO-aktivitet udtrykkes i U pr. proteinindhold (U/g protein). Resultater vist som middel ± SEM, ** p < 0,01, n = 5-6 mus / gruppe. Forkortelser: CHS = kontaktoverfølsomhedsreaktion; MPO = myeloperoxidase; SEM = standardfejl i middelværdien; TNCB = 2,4,6-trinitrochlorbenzen U = enheder. Klik her for at se en større version af denne figur.

Figur 6: Repræsentativ evaluering af cytokinproduktion-IFN-γ koncentration i øreekstrakter. Mus blev TNCB (testgruppe) eller sham (kontrolgruppe) sensibiliseret og efterfølgende udfordret. Ved 24 timer efter udfordring blev ørerne fjernet, og 6 mm diameter slag på øret blev taget. Koncentrationen af IFN-γ blev bestemt i vævshomogenater ved ELISA. Resultater vist som middel ± SEM, *p < 0,05, n = 5 mus/gruppe. Forkortelser: CHS = kontaktoverfølsomhedsreaktion; IFN-γ = interferon gamma; SEM = standardfejl i middelværdien; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at se en større version af denne figur.

Figur 7: Repræsentativ histologi af ørevævet. Hæmatoxylin og eosinfarvning. Mus blev TNCB (testgruppe) eller sham (kontrolgruppe) sensibiliseret og efterfølgende udfordret. (A-C) Histologisk undersøgelse i testgruppen manifesterede sig i en signifikant øget koncentration af inflammatoriske celler (mononukleære og polymorfonukleære celler), hovedsageligt i dermis, med mikroabscessdannelse i epidermis. Fortykkelse af den edematøse dermis og en fortykket, hyperplastisk epidermis blev også bemærket. (D-E) Kontrolgruppe. Klik her for at se en større version af denne figur.

Figur 8: Repræsentativ vaskulær permeabilitetstest. Observeret ørevævsødem er et resultat af øget vaskulær permeabilitet. For at bestemme ændringer i vaskulær permeabilitet blev mus TNCB (testgruppe) eller sham (kontrolgruppe) sensibiliseret og derefter udfordret 4 dage senere. 23 timer efter udfordringen blev Evans blå injiceret, og 1 time efter Evans blå injektion blev dyrene aflivet, og der blev lavet 6 mm diameter slag i øret. Resultater vist som middel ± SEM, **p < 0,01, n = 5 mus/gruppe. Forkortelser: CHS = kontaktoverfølsomhedsreaktion; SEM = standardfejl i middelværdien; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at se en større version af denne figur.

Figur 9: Repræsentativ anti-TNP IgG1 antistofmåling. Koncentrationen af anti-TNP IgG1 antistoffer i serum blev målt 24 timer efter udfordringen med hapten TNCB i sham sensibiliserede (kontrol) og i TNCB-sensibiliserede (testgruppe) mus. De indsamlede sera blev testet for antistofkoncentration ved ELISA. Resultater vist som middel ± SEM, ***p < 0,001, n = 10 mus/gruppe. Forkortelser: CHS = kontaktoverfølsomhedsreaktion; IgG1 = immunglobulin G underklasse 1; SEM = standardfejl i middelværdien; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at se en større version af denne figur.

Figur 10: Repræsentativ adoptivoverførsel af CHS-effektorcellerne. CHS-effektorcellerne blev opnået fra donorer, der blev sensibiliseret med TNCB. Dernæst blev de indsamlede immunceller injiceret, dvs. i naive syngeneiske modtagere, som blev udfordret til udløsning af CHS-effektorfasen. Kontrolgruppen af mus modtog ingen celler før udfordringen. Tykkelsen af auricleen blev målt før og efter udfordringen. Resultater vist som middel ± SEM, ***p < 0,001, n = 7 mus/gruppe. Forkortelser: CHS = kontaktoverfølsomhedsreaktion; SEM = standardfejl i middelværdien; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at se en større version af denne figur.
| Mus stamme | Sensibiliseringsopløsning (dosis) på barberet mave |
Udløsningsopløsning (dosis) på begge sider af øret/ s |
Sensibilisering / udløsning dag | Refs | |||||||||||
| BALB/c (H-2d); C57BL/6 (H-2b) TCRδ-/-, β2m-/-, CD1d-/- (B10 PL (H-2u baggrund) |
25 μL 0,5 % DNFB i acetone-olivenolieblanding (forhold 4:1) | 5 μL 0,1 % DNFB i acetone-olivenolieblanding (forhold 4:1) | 0 / 5 | 22 | |||||||||||
| C57BL/6 (H-2b) | 50 μL 0,5 % DNFB i acetone-olivenolieblanding (forhold 4:1) | 25 μL 0,2 % DNFB i acetone-olivenolieblanding (forhold 4:1) | 0 / 5 | 32 | |||||||||||
| C57BL/6 (H2b); IL-17A-/- (C57BL/6 baggrund) | 150 μL 5% TNCB i acetone-ethanolblanding (forhold 1:3) | 10 μL 0,4 % TNCB i blanding af olivenolie og acetone (forhold 1:1) | 0 / 4 | 33 | |||||||||||
| CBA/J (H-2k); C57BL/6 (H-2b) TLR2-/-, MyD88-/-, IL-17A-/- (C57BL/6 baggrund) |
150 μL 5 % TNP-Cl (TNCB) i en acetone-ethanolblanding (forhold 1:3) | 10 μl 0,4 % TNP-Cl (TNCB) i olivenolie-acetoneblanding (forhold 1:1) | 0 / 4 | 21 | |||||||||||
| C57BL/6 (H-2b); BALB/c (H-2d) | 25 μL 1 % TNCB i en acetone | 10 μL 0,1 eller 0,2 % TNCB i en acetone (og højere op til 1 %) | 0 / 7 | 34 | |||||||||||
| C57BL/6 (H-2b); TLR2-/-/ TLR4-/- (dobbelt knockout mus på C57BL/6 baggrund) |
100 μL 3 % TNCB i en acetone | 20 μL 1 % TNCB i en acetone (lige på bagsiden af ørerne) | 0 / 5 | 31 | |||||||||||
| C57BL/6 (H-2b) Mus med MHC klasse II-mangel (C57BL/6 baggrund) |
100 μL 3 % TNCB i acetone-olivenolieblanding (forhold 4:1) | 20 μL 0,5 eller 1 % TNCB i acetone-olivenolieblanding (forhold 4:1) | 0 / 6 | 35 | |||||||||||
| C57BL/6 (H-2b) | 100 μL 7 % TNCB i en acetone | 20 μL 1 % TNCB i en acetone | 0 / 5 | 36 | |||||||||||
| C57BL/6 (H-2b) | 100 μL 3 % OX i ethanol | 20 μL 1 % OX i ethanol | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/6 baggrund) | 25 μL 0,5 % DNFB i acetone-olivenolie (forhold 4:1) | 10 μL 0,2 % DNFB i acetone-olivenolie (forhold 4:1) | 0 / 5 | 10 | |||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/6 baggrund) | 150 μL 3 % OX i alkohol-acetone (forhold 3:1) | 10 μL 1% OX i alkohol-acetone (forhold 3:1) | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); C3H/HeN (H-2k); TLR4-/- (C3H/HeJ baggrund); MyD88-/- (C57BL/6 baggrund) | 100 mg/øre 10 % NiCl2 i hvid petrolatum på dorsalsiden af begge ører | 10 % NiCl2 i hvid petrolatum | 0,1,2 / 23, 24 | 37 | |||||||||||
| NOD (H-2g7) MyD88-/- (NOD-baggrund) | 400 μL 0,5 % FITC i acetone og dibutylphthalat | 10 μL 0,1 % FITC i acetone og dibutylphthalat | 0 / 5 | 25 | |||||||||||
Tabel 1: Sammenligning af CHS-modellen i forskellige undersøgelser. Forkortelser: DNFB = 1-fluor-2,4-dinitrobenzen; FITC = fluoresceinisothiocyanat; NiCl2 = nikkel (II) chlorid; TNCB = 2,4,6-trinitrochlorbenzen TNP-Cl = trinitrophenylchlorid; OX = oxazolon. Klik her for at downloade denne tabel.
| Kontrolgruppe (negativ) | Testgruppe (CHS-reaktion) | ||||||
| Mus # øre: L, R | 0 h øretykkelse [μm] | 24 timers øretykkelse [μm] | 24 timer – 0 timers øretykkelse [μm] | Mus # øre: L, R | 0 h øretykkelse [μm] | 24 timers øretykkelse [μm] | 24 timer – 0 timers øretykkelse [μm] |
| 1 L | 365 | 380 | 15 | 1 L | 345 | 427.5 | 82.5 |
| 1 R | 335 | 380 | 45 | 1 R | 340 | 455 | 115 |
| 2 L | 345 | 355 | 10 | 2 L | 355 | 475 | 120 |
| 2 R | 327.5 | 352.5 | 25 | 2 R | 342.5 | 457.5 | 115 |
| 3 L | 340 | 370 | 30 | 3 L | 340 | 460 | 120 |
| 3 R | 325 | 355 | 30 | 3 R | 345 | 495 | 150 |
| 4 L | 335 | 380 | 45 | 4 L | 357.5 | 432.5 | 75 |
| 4 R | 340 | 350 | 10 | 4 R | 335 | 402.5 | 67.5 |
| 5 L | 350 | 380 | 30 | 5 L | 335 | 387.5 | 52.5 |
| 5 R | 337.5 | 360 | 22.5 | 5 R | 335 | 425 | 90 |
| 6 L | 335 | 365 | 30 | 6 L | 350 | 430 | 80 |
| 6 R | 340 | 375 | 35 | 6 R | 342.5 | 405 | 62.5 |
| 7 L | 345 | 337.5 | 0 | 7 L | 340 | 502.5 | 162.5 |
| 7 R | 345 | 335 | 0 | 7 R | 327.5 | 447.5 | 120 |
| 8 L | 370 | 380 | 10 | 8 L | 327.5 | 515 | 187.5 |
| 8 R | 375 | 355 | 0 | 8 R | 327.5 | 540 | 212.5 |
| 9 L | 385 | 370 | 0 | 9 L | 330 | 415 | 85 |
| 9 R | 342.5 | 362.5 | 20 | 9 R | 327.5 | 390 | 62.5 |
| 10 L | 307.5 | 340 | 32.5 | 10 L | 337.5 | 445 | 107.5 |
| 10 R | 325 | 350 | 25 | 10 R | 352.5 | 455 | 102.5 |
| Betyde | 20.75 | Betyde | 108.5 | ||||
| ± SEM | 3.245 | ± SEM | 9.565 | ||||
Tabel 2: Repræsentativt eksempel på beregning af forskellen i øretykkelse i effektorfasen af CHS. Beregning af forskellen i tykkelsen af auriklen før og efter udfordringen med hapten: 24 h øretykkelse (μm) - 0 h øretykkelse (μm). Hvert øre tæller som en separat måling. Øre hævelse udtrykt i mikrometer (μm) ± SEM, n = 20. Forkortelser: L = venstre; R = højre. Klik her for at downloade denne tabel.
| iSTD-fortynding med AD | anti-TNP IgG1 Ab (U/ml) |
| 100 gange | 250 |
| 200 gange | 125 |
| 400 gange større | 62.5 |
| 800 gange | 31.25 |
| 1600 gange | 15.63 |
| 3200 gange større | 7.8 |
| kun AD | 0 |
Tabel 3: Forberedelse af de forskellige koncentrationer af iSTD til standardkurven for anti-TNP IgG1 Ab-måling. 100x iSTD-fortyndingen blev antaget at være 250 U af anti-TNP IgG1 Ab. Forkortelser: Ab = antistof; AD = analyse fortyndingsmiddel; iSTD = intern standard; IgG1 = immunglobulin G underklasse 1; TNP = 2,4,6-trinitrophenyl; U = enheder. Klik her for at downloade denne tabel.
Supplerende figur 1: Fænotypen af CHS-effektorceller. CHS-effektorcellerne blev opnået fra donorernes ALN'er og SPL'er, som tidligere var sensibiliseret med TNCB. (A) Ved anvendelse af MACS-teknikken blev CHS-effektorcellerne (hele ALN'er og SPL'er) udtømt for enten CD4+ eller CD8+-celler. Efterfølgende blev adoptivcelleoverførsel udført før udløsningen af CHS-effektorfasen. Ørehævelse blev udtrykt som middel ± SEM. (B-E) Ved hjælp af en flowcytometriteknik blev CHS-effektoren og naive (opnået fra naive mus) celler farvet for IFN-γ, Tbet, IL-17A og RORγt inden analyse. Celler blev gated for TCRβ + CD4 + populationen. Resultater vist som middel ± SEM, ***p < 0,001, **p < 0,01, * p < 0,05, n = 4-6 mus/gruppe. Forkortelser: ALN'er = aksillære og inguinale lymfeknuder; CD4 = klynge af differentiering 4; CHS = kontaktoverfølsomhedsreaktion; IFN-γ = interferon gamma; IL = interleukin; MACS = magnetisk aktiveret cellesortering; ns = ikke signifikant; RORγt = retinsyre-receptor-relateret forældreløs nuklear receptor gamma; SEM = standardfejl i middelværdien; SPL 'er = milt; Tbet = T-box transkriptionsfaktor TBX21; TCRβ = T-cellereceptor beta; TNCB = 2,4,6-trinitrochlorbenzen. Klik her for at downloade denne fil.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
CHS induceres via haptens, som binder til selvproteinantigener i huden og skaber neoantigener. CHS medieres ved lokal ekstravaskulær rekruttering af cirkulerende antigenspecifikke CHS-effektor T-celler, hvilket resulterer i hævelse i det udfordrede væv, der topper 24 timer efter eksponering af sekundær hud for den samme hapten6. Hævelsen af vævet er hovedsageligt forårsaget af infiltration af leukocytter og leukocytafhængig fibrinaflejring24. Disse ændringer kan påvises med et mikrometer, der måler ørehævelsen hos hapten-sensibiliserede og udfordrede versus sham-sensibiliserede og udfordrede mus.
CHS kan også bestemmes ved sammenligning af ørevægt. Derefter kan øreslagene, der bruges til bestemmelse af ørevægt, bruges til yderligere tests. Celleinfiltrationerne i de betændte ører består af cytokinproducerende T-lymfocytter og MPO-positive neutrofiler. I ørevævshomogenater kan forskellige parametre måles, såsom MPO-aktivitet eller koncentrationen af proinflammatoriske cytokiner (f.eks. TNF-α, IFN-γ, IL-17A eller andre) ved hjælp af ELISA-testen eller ekspressionen af cytokin-mRNA'et i huden ved hjælp af qPCR-testen25. Derudover kan ændringer i fartøjets permeabilitet evalueres ved hjælp af Evans blå test21,26.
I det betændte ørevæv kan de observerede ændringer også suppleres med in vitro-tests, der fremhæver T-celleproliferation og cytokinproduktion. Dette kan let opnås ved dyrkning af ALN'er i nærværelse af haptenkonjugerede proteinantigener22,27. Evalueringen af cytokinsekretion af ALN'er isoleret fra sensibiliserede, men ikke udfordrede mus giver detaljer om cytokinproduktion af CHS-effektorcellerne i stedet for deres induktion.
Begrænsninger
Mange mikrometer måler øre hævelse med forskellig nøjagtighed. For eksempel udøves det laveste tryk af en fjederkaliper, så det ser ud til, at resultaterne bedst afspejler den faktiske tykkelse øremåling. Imidlertid vil mikrometre, der udøver mere tryk, såsom Mitutoyo, sandsynligvis komprimere tættere væsken, der akkumuleres i ørerne i den tidlige fase af ødemdannelse. Den bifasiske karakter af CHS kan visualiseres tydeligere ved hjælp af sådanne mikrometre, fordi der udøves mere tryk. Dette er vanskeligere, når du bruger en fjederkaliper med let tryk28. Ikke desto mindre blev ørens tykkelse i nogle undersøgelser målt med en tykkelse29. Observatørens erfaring sikrer også nøjagtige målinger, som kan påvirkes af subjektive følelser, selvom observatøren ikke er opmærksom på de eksperimentelle grupper.
Alternative metoder er blevet beskrevet her, der kan hjælpe med at bekræfte målingerne af øre hævelse med et mikrometer, hvilket gør de præsenterede data mere pålidelige og mindre subjektive. Disse alternative strategier til vurdering af CHS kan dog kun anvendes på ét tidspunkt. Mikrometermålinger kan gentages på forskellige tidspunkter, hvilket giver mulighed for at studere CHS-kinetikken.
Ændringer
Protokollen til undersøgelse af CHS-reaktionen, vi bruger i vores laboratorium, adskiller sig væsentligt fra dem, der anvendes i andre laboratorier, herunder dosis hapten og opløsningsmiddelsammensætningen, der anvendes til både udløsning og sensibilisering, samt det tidspunkt, hvor reaktionen vurderes. Øretykkelsen kan måles på forskellige tidspunkter (f.eks. 2 timer, 24 timer, 48 timer og 72 timer efter udfordringen)10,30. Tabel 1 viser forskellige forsøgsmodeller, især forskellene i dyrestammen, hapten og de sensibiliserings-/udfordringstider, der er anvendt i forskellige undersøgelser 10,21,22,26,31,32,33,34,35,36,37 . CHS-protokollen kan også udføres uden forudgående barbering af musens mave.
Den næste forskel vedrører udførelsen af selve udløsningen (udfordringen). Som det er typisk, sker sensibiliseringen ved at male barberede mus underlivshud med hapten eller køretøjet alene. Efterfølgende udfordres det ene øre i begge grupper med fortyndet hapten på hver øreside. Som kontrol er det modsatte øre malet med en identisk mængde køretøj alene10,31.
Kritiske trin
Det mest kritiske øjeblik er at udløse CHS, da testresultaterne afhænger af det. (1) Hapten-opløsningen er meget flygtig og lysfølsom, så den skal være tæt lukket og beskyttet mod lys, og når den er i brug, skal den hurtigt påføres dyrenes hud, så den ikke fordamper. (2) Efter påføring af hapten på mavens hud skal den tørres, før dyret vender tilbage til buret, fordi mus kan smøre det mod strøelse eller påføre det på ørerne med deres poter (så kan målingen af tykkelsen af auriklen være utilstrækkelig). (3) Der kendes også forskellige metoder til mærkning af dyr, f.eks. mærkning af musehaler med en opløsningsmiddelresistent markør. Imidlertid kan farvestofferne, der er til stede i markøren, (ikke undersøgt) blive en hapten og udløse CHS. Derfor blev der i denne undersøgelse valgt en mærkningsmetode, der ikke påvirker reaktionen. (4) Det er meget vigtigt at vælge en barberingsmetode, da det kan irritere huden. I denne protokol blev der brugt en grå sæbe, fordi den har beroligende egenskaber; det fremskynder behandlingen af mindre nedskæringer og festering sår, hvilket er hjulpet af dets antibakterielle virkninger. Det lindrer hævelse og betændelse i huden.
Yderligere undersøgelser og standardisering af forsøgsprocedurerne, herunder anvendelse af dyr (stamme og køn), er nødvendige for at sammenligne resultaterne fra forskellige undersøgelser.
Mange forskellige miljøfaktorer og nye stoffer med biologiske funktioner kan testes i CHS-modellen. Denne model kan være nyttig, hvis forskere vil vise, om testede faktorer modulerer T-celleafhængige immunresponser.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har intet at afsløre.
Acknowledgments
Denne undersøgelse blev støttet af subvention SUBZ. A020.22.060 fra Medical University i Wroclaw, Polen, og ved tilskud fra Ministeriet for Videnskab og Videregående Uddannelse N N401 545940 til MS og IP2012 0443 72 til MMS.
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
Immunologi og infektion udgave 187 Murine-model allergisk kontaktdermatitis (ACD) kontaktoverfølsomhed (CHS) hævelse i øret vaskulær permeabilitet myeloperoxidase (MPO) cytokiner 2,4,6-trinitrochlorbenzen (TNCB) haptenErratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
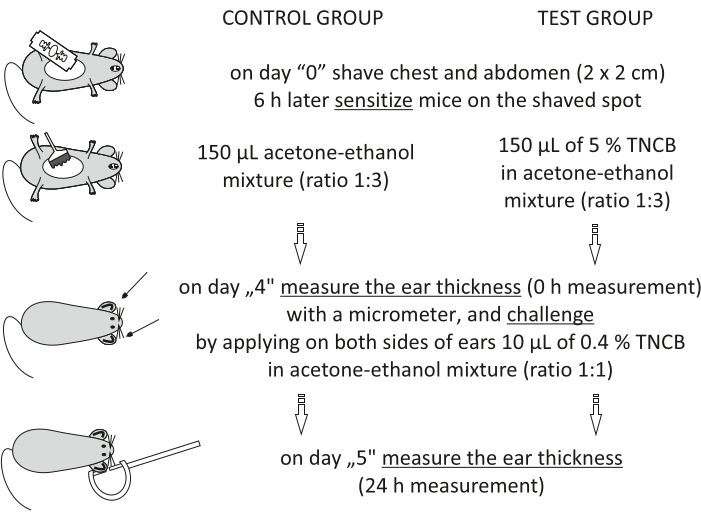
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
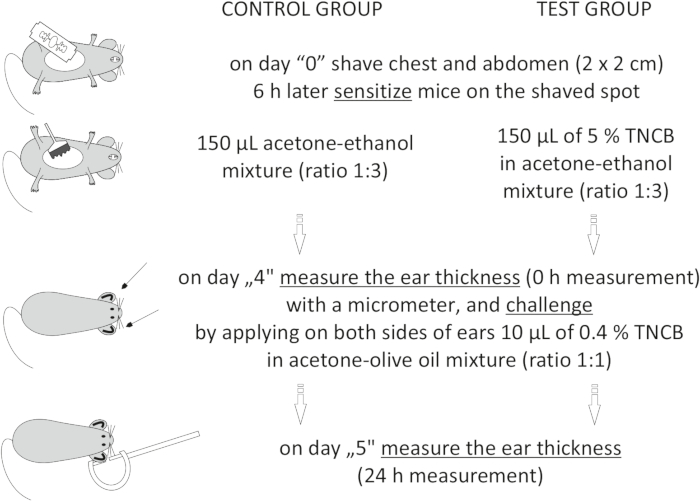
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
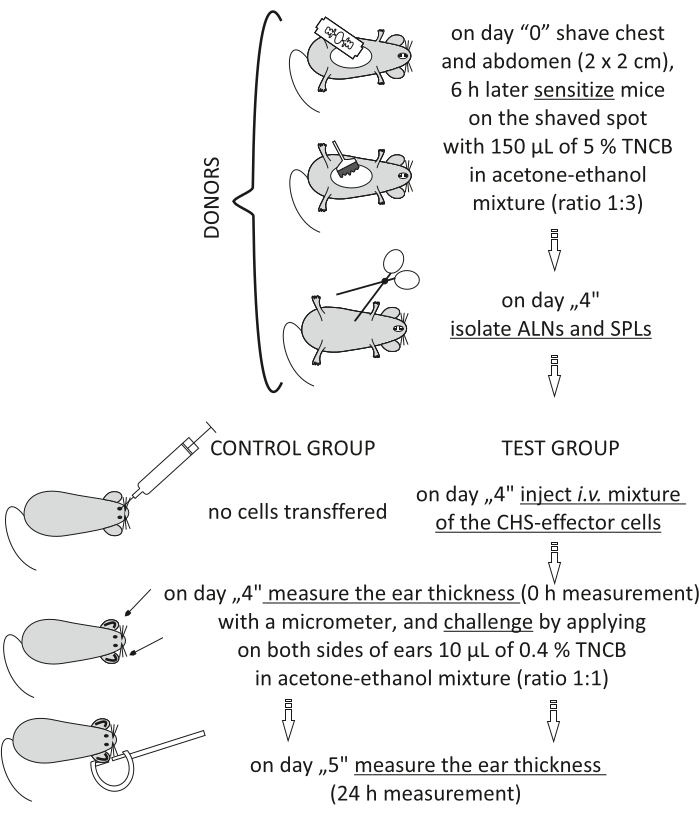
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
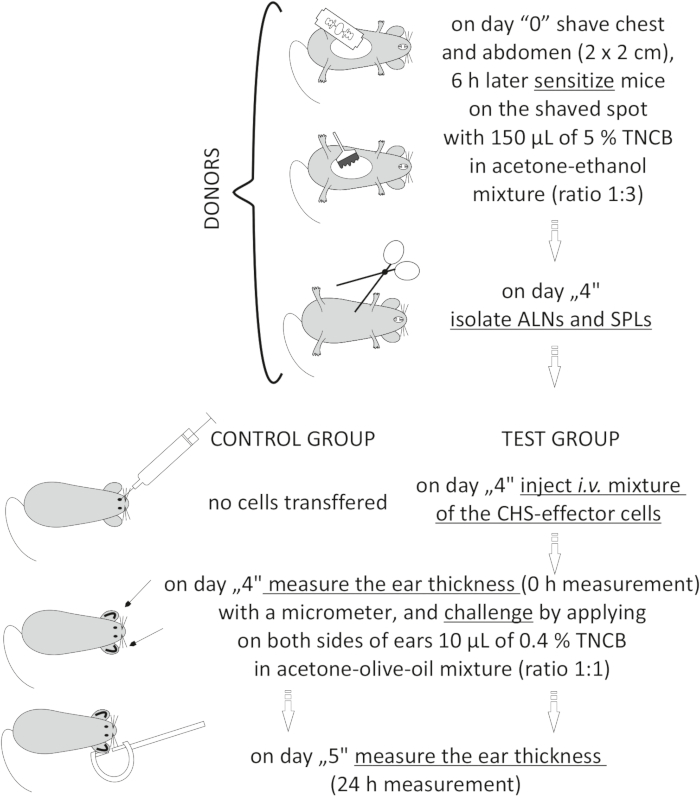
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



