ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Kontakt overfølsomhet (CHS) er en murine eksperimentell modell av allergisk kontaktdermatitt (ACD). CHS er basert på sensibilisering med reaktiv hapten ved å male den barberte huden på brystet og magen, med en påfølgende ørehudutfordring med en fortynnet hapten, noe som forårsaker en hevelsesreaksjon som vurderes på forskjellige måter.
Abstract
Kontakt overfølsomhet (CHS) er en eksperimentell modell av allergisk kontaktdermatitt (ACD) som kan studeres hos mus. Denne studien tar sikte på å presentere en objektiv laboratoriemetode som kan bidra til å studere CHS-reaksjonen hos mus, som kan måles og kvantifiseres ved ulike tester. For å indusere CHS, på dag "0", ble mus sensibilisert på et tidligere barbert sted ved abdominal hudmaling med hapten 2,4,6-trinitroklorbenzen (TNCB) i en aceton-etanolblanding, mens negative kontrollmus ble humbug sensibilisert med kjøretøyet alene-aceton-etanolblanding. På dag "4" ble øretykkelsen målt med et mikrometer før CHS (utfordring) ble fremkalt ved å male begge ørene med fortynnet TNCB både i test- og kontrollgruppene. Etter 24 timer ble ørehevelsen målt med et mikrometer. CHS er et eksempel på en T-cellemediert immunrespons som forårsaker hevelse i betent vev, med en topp 24 timer etter hudutfordringen med samme hapten. En økning i øreødem korrelert med økt ørevekt, myeloperoksidase (MPO) aktivitet, proinflammatorisk cytokinkonsentrasjon i øreekstraktene, økt fortykkelse av edematøs dermis i histologisk undersøkelse og øre vaskulær permeabilitet. Det var også en økning i konsentrasjonen av TNP-spesifikke IgG1-antistoffer i sera i testgruppen sammenlignet med kontrollmusene. I tillegg kan CHS overføres med CHS-effektorceller oppnådd fra givere som tidligere er sensibilisert med TNCB. CHS-effektorcellene ble administrert intravenøst til naive mottakermus, som senere ble utfordret med samme fortynnede hapten. Ørehevelse ble målt med et mikrometer 24 timer senere.
Introduction
Allergisk kontaktdermatitt (ACD) er en vanlig hudinflammatorisk sykdom i industrialiserte land forårsaket av en type IV overfølsomhetsreaksjon som følge av eksponering for kjemikalier med lav molekylvekt kalt haptens. Stoffene som forårsaker kontaktsensibilisering hos mennesker inkluderer tungmetallioner (krom, nikkel, jern, kobolt), terpentin, dufter, fargestoffer og konserveringsmidler som finnes i kosmetikk (f.eks. p-fenylendiamin), noen stoffer (f.eks. Neomycin, benzokain), β-laktamantibiotika (dvs. penicillin), kjemikalier produsert av planter (pentadecacatechol, et stoff som finnes i gift eføy), samt hydrokinon brukt i fotografisk industri 1,2 . ACD etiologiske midler er svært høye da over 100 000 kjemikalier brukes i industrien alene, og 2000 nye syntetiseres hvert år. Til nå er det identifisert mer enn 3 700 molekyler som kan være kontakthalpter/allergener3. Kontaktoverfølsomhetsreaksjonen (CHS) er en eksperimentell modell av ACD som kan studeres hos mus, marsvin og rotter og kan induseres ved lokal hudpåføring av reaktive kjemiske haptens oppløst i organiske løsningsmidler 4,5,6. Denne studien tar sikte på å beskrive en objektiv laboratoriemetode som kan bidra til å studere CHS-reaksjonen hos mus, som kan måles og kvantifiseres ved ulike tester.
CHS består av sensibiliseringsfaser (induksjon) og effektorfaser (utfordring). I dyremodeller binder haptens først kovalent til proteiner i kroppen for å skape neoantigener. I løpet av sensibiliseringsfasen fremmer aktiverte keratinocytter migrasjon og modning av huddendrittiske celler (SDC) ved å produsere proinflammatoriske cytokiner-tumornekrosefaktor α (TNF-α) og interleukin 1β (IL-1β)7. Epidermale Langerhans-celler (LCs) presenterer antigener under CHS-induksjons- og effektorfasene8. LC utsatt for hapten under sensibilisering fremmer induksjon av både regulatoriske og effektorceller9. Økende bevis fra flere studier tyder på at CHS-responser kan medieres av enten CD4+ MHC klasse II-begrensede Th1-celler, som lokalt frigjør interferon-γ (IFN-γ) til å benytte et karakteristisk inflammatorisk infiltrat, CD8+ MHC klasse I-begrensede Tc1-lymfocytter som også kan frigjøre IFN-γ men for det meste mediere cytotoksisk skade på keratinocytter, og nå også interleukin 17 (IL-17)-produserende Th17-celler10, 11. 11.
Det er utviklet flere ulike CHS-modeller med ulike arter1 2,13,14 og haptener (en detaljert sammenligning av ulike haptener, løsemidler og påføringstidspunkt er oppsummert i tabell 1). Musen, en ofte brukt laboratorieart, gir noen fordeler ved å studere CHS. Det er flere stammer, knockouts (KO) og transgene dyr blant mus sammenlignet med andre arter, noe som gjør dem til et veldig attraktivt dyr15. I tillegg krever CHS-modellen mange dyr, og mus er mer økonomiske her. Dyremodeller etterligner ikke ACD i alle aspekter; spesielt viser de crusting og desquamation, noe som ikke er vanlig for mennesker16,17. Funksjonene ved kronisk sykdom er utfordrende å reprodusere, hovedsakelig fordi den beskrevne modellen ikke antar anvendelsen av hapten i lang tid. Det har imidlertid blitt bekreftet her at mange av de viktige aspektene ved ACD er gjengitt. Det har også vist seg at, som hos mennesker, er disse funksjonene forbundet med lokale allergiske reaksjoner. Valget av hapten, dets løsningsmiddel og dets anvendelse skissert i denne protokollen ble diktert av det faktum at resultatene har blitt bekreftet av mange in vitro-tester, og at den ble testet og modifisert i laboratoriet i mange år til den nåværende versjonen ble etablert. Murine modeller tillater analyse av celleundergrupper eller cytokiner som er involvert i utviklingen av ACD og er avgjørende for prekliniske vurderinger av nye behandlinger.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alle forsøkene som presenteres i denne artikkelen ble utført i henhold til retningslinjene fra 1st Local Ethical Committee on Animal Testing i Krakow. Alle de beskrevne prosedyrene ble utført i henhold til de lokale anbefalingene, spesielt når det gjaldt bruk av ketamin/xylazin som bedøvelsesmiddel, bruk av begge sider av ørene for å påføre stoffet/hapten, kutte av øret og samle blod ved øyebollfjerning. BALB/c (haplotype H-2d), CBA/J (H-2k) og C57BL/6 (H-2b) hann- og hunnmus, 6-12 uker gamle, ble brukt i denne studien (se materialtabell). For statistisk signifikans er det best hvis hver gruppe mus består av 10-12 dyr.
1. Forberedelse av dyr
- Rengjør operasjonsbordet med en 70% etanolløsning før og etter alle prosedyrer. Hvis du bruker mus som krever sterile forhold, utfør alle operasjoner i et biosikkerhetsskap.
2. Merking av mus for identifikasjon
- Merk musene ved å barbere huden med et barberblad: # 0 - umerket, # 2 - på høyre fremre pote, # 3 - på høyre side, # 4 - på høyre bakpote, # 5 - ved foten av halen, # 6 - på venstre bakpote, # 7 - på venstre side, # 8 - på venstre fremre pote.
MERK: På grunn av den induserte reaksjonen kan mus ikke merkes klassisk ved ørestansing eller merking. Musene ble ikke bedøvet under merking.
3. Induksjon av CHS
MERK: Denne prosedyren er beskrevet i figur 1.
- Utfør sensibiliseringen (induksjonen) ved å følge trinnene nedenfor.
- På dag "0" barber mus på brystet og magen (kvadrat 2 cm x 2 cm) ved å påføre grå såpe med vann og barbering med et barberblad.
MERK: Før du bruker hapten, vent i 6 timer slik at huden ikke blir irritert. - Forbered 5% hapten: 2,4,6-trinitroklorbenzen (TNCB, se Materialtabell) i en aceton-etanolblanding (forhold 1:3) eller kjøretøy alene (aceton-etanol). Klargjør oppløsningen rett før bruk i et hetteglass og beskytt den mot lys ved å dekke hetteglasset med aluminiumsfolie.
- Samme dag sensibiliserer musene ved å påføre 150 μL 5% hapten på det tidligere barberte stedet. I gruppen av kontrollmus, bruk kjøretøyet alene for å vurdere den ikke-spesifikke inflammatoriske reaksjonen. Før du legger dyret tilbake i buret, vent i 30 s, la hapten tørke.
FORSIKTIG: Bruk hansker; TNCB forårsaker en alvorlig allergisk reaksjon hos de fleste.
- På dag "0" barber mus på brystet og magen (kvadrat 2 cm x 2 cm) ved å påføre grå såpe med vann og barbering med et barberblad.
- Utfør elicitation (utfordring) og øre hevelse måling.
- På dag "4", lag 0,4% hapten: TNCB i en aceton-etanolblanding (forhold 1:1). Klargjør oppløsningen rett før bruk i et hetteglass og beskytt den mot lys ved å dekke hetteglasset med aluminiumsfolie.
- Bedøv musene med en intraperitoneal (dvs.p.) injeksjon av en blanding av ketamin (90-120 mg/kg) og xylazin (5-10 mg/kg) (se materialtabell) for dyp anestesi. Forsikre deg om at musen er fullstendig bedøvet i minst 5 minutter med tåklemme.
- Mål øretykkelsen (0 timers måling, baseline) med et mikrometer (se materialtabell) av en observatør uvitende om eksperimentelle grupper.
- Påfør 10 μL av 0,4% hapten på begge sider av ørene i begge grupper (test og kontroll). Før du setter dyret tilbake i buret, vent i 30 s og la hapten tørke.
- På dag "5", 24 timer etter påføring av hapten, gjenta trinn 3.2.2-3.2.3 for 24 timers måling.
- Evaluer CHS-responsen ved å beregne forskjellen i auricletykkelse før og etter utfordringen med hapten: 24 timers øretykkelse (μm) - 0 timers øretykkelse (μm). Tell hvert øre som en separat måling. Deretter uttrykker øret hevelse i mikrometer (μm) ± standardfeil av gjennomsnittet (SEM) (tabell 2, figur 3).
4. Ørebiopsier
- Rett etter 24 timers måling av øretykkelse (når musen fortsatt er under dyp anestesi), kutt av ørene så nær skallen som mulig med saks. Samle biopsiene fra den distale siden av ørene ved å lage en 6 mm diameter slag ved hjelp av en biopsi punch (se Tabell over materialer).
- Mål ørevekten (trinn 4.2) og utfør i tillegg en av følgende tester på samme ørebiopsi: myeloperoksidase (MPO)-analyse (trinn 4.3) eller in vitro-måling av cytokinkonsentrasjon i øreekstraktene (f.eks. IFN-γ, IL-17A, TNF-α [trinn 4.4]).
MERK: Klipp ørene før blodinnsamling. Etter denne prosedyren må musene avlives (f.eks. ved cervikal dislokasjon).
- Mål ørevekten (trinn 4.2) og utfør i tillegg en av følgende tester på samme ørebiopsi: myeloperoksidase (MPO)-analyse (trinn 4.3) eller in vitro-måling av cytokinkonsentrasjon i øreekstraktene (f.eks. IFN-γ, IL-17A, TNF-α [trinn 4.4]).
- Mål vekten av hver ørebiopsi på analysebalansen og uttrykk den i milligram (mg) (figur 4).
- Utfør en MPO-analyse ved å følge trinnene nedenfor.
- Forbered homogeniseringsbuffer ved å oppløse 0,5% heksadecyltrimetylammoniumbromid i 50 mmol fosforbuffer KH2PO4 / Na2HPO4 og justere pH til 6,0 (bruk ved romtemperatur, RT).
- Homogeniser biopsiene i 2 ml mikrosentrifugerrør med 500 μL tilberedt buffer i 10 minutter ved hjelp av en homogenisator med 5 mm diameter rustfritt stålperler (tilsett to perler / hetteglass) (se materialtabell). Kjøl deretter ned prøven i 15 minutter ved 4 °C og homogeniser den i ytterligere 10 minutter.
MERK: Microcentrifuge rør har en rund bunn slik at perlene lett kan bevege seg. - Frys homogenatene ved −20 °C i 30 minutter. Tine og virvel (sørg for at prøvene tines). Gjenta denne prosedyren 3x.
- Sentrifuger homogenatene ved 3000 x g i 30 minutter ved 4 °C. Høst supernatantene med en pipette. Uttrykk MPO-aktiviteten i enheter (U) per 1 mg protein.
MERK: Protokollen kan settes på pause her. Prøvene er stabile ved −20 °C i 3 måneder. - For å måle MPO-aktivitet, utfør en enzymatisk reaksjon ved å blande 20 μL supernatant og 200 μL MPO-substrat (0,167 mg / ml orto-dianisindihydroklorid i 50 mmol KH2PO4 / Na2HPO4 buffer med 5 x 10-4% H202) og tilsett i 96-brønns flatbunnsplater. Inkuber platene i 20 minutter ved RT.
- Forbered standardkurven ved å bruke 20 μL av MPO-standarden ved konsentrasjoner fra 0,008 U opp til 0,5 U i 200 μL av MPO-substratet. Forbered den tomme prøven med MPO-substratet alene.
FORSIKTIG: Bruk en maske mens du arbeider med orto-dianidindihydroklorid.
MERK: Platene må være laget av polypropylen, som har lavere bindingskapasitet, slik at proteiner eller DNA ikke vil binde seg. - Mål den optiske tettheten (OD) ved en bølgelengde på λ = 460 nm. Den enzymatiske reaksjonen er stabil i 10 minutter. Les MPO-aktiviteten i testede prøver fra standardkurven.
- For å måle proteinkonsentrasjon, bruk 20 μL av supernatanten, utfør en test med et bicinchoninic acid kit for proteinbestemmelse (se Materialtabell), og mål OD ved λ = 562 nm (figur 5).
- Utfør in vitro måling av cytokiner i øreekstraktet.
- Homogeniser ørebiopsiene ved RT i 2 ml mikrocentrifugerør med 500 μL vevsproteinekstraksjonsreagens (T-PER) i 10 minutter ved bruk av en homogenisator med 5 mm diameter rustfritt stålperler (tilsett to perler / hetteglass). Kjøl deretter ned prøven i 15 minutter ved 4 °C og homogeniser den i ytterligere 10 minutter.
MERK: Microcentrifuge rør har en rund bunn slik at perlene lett kan bevege seg. - Sentrifuger homogenatene ved 3000 x g i 30 minutter ved 4 °C.
MERK: Protokollen kan settes på pause her. Prøvene er stabile ved −80 °C i 6 måneder. - Vurder cytokinnivåene ved hjelp av et kommersielt tilgjengelig ELISA-sett (f.eks. IFN-γ) (se materialtabell) i henhold til produsentens instruksjoner (figur 6).
- Homogeniser ørebiopsiene ved RT i 2 ml mikrocentrifugerør med 500 μL vevsproteinekstraksjonsreagens (T-PER) i 10 minutter ved bruk av en homogenisator med 5 mm diameter rustfritt stålperler (tilsett to perler / hetteglass). Kjøl deretter ned prøven i 15 minutter ved 4 °C og homogeniser den i ytterligere 10 minutter.
5. Histologi av ørevev
- Rett etter 24 timers måling av øretykkelse, når musen fortsatt er dypt bedøvet, kutt av ørene så nær skallen som mulig med saksen (trinn 4.1).
MERK: Etter denne prosedyren må musene avlives (f.eks. ved cervikal dislokasjon). - Utfør parafininnbygging av vevsblokkene ved å følge trinnene nedenfor.
- Rett etter fjerning, plasser øret i ~ 10 ml 10% formalin i 24 timer.
- Plasser ørene i en vevsbehandlingskassett. Sett kassettene i en automatisert prosessor (se materialtabell) for dehydreringssykluser (alkohol 70%, 90%, 100%, 30 min hver ved RT), ryddesykluser (xylen 3x, 30 min hver ved RT) og voksinfiltrasjonssykluser (parafin 3x, 30 min hver ved 56 °C).
- Fjern kassettene fra den automatiserte prosessoren, og hold på varmeplaten til det er nødvendig. Fyll voksformen med varm voks (fra dispenseren).
- Fjern seksjonene fra kassetten med oppvarmede tang og legg dem i formen; Legg deretter kassettbunnen på toppen av formen og fyll deretter med mer voks. Legg den i kaldt vann på en kald plate i 30 minutter slik at parafinen stivner for å danne en blokk som inneholder prøven.
- Bruk en roterende mikrotom (se Materialtabell) for å kutte seksjoner ~ 5 μm tykke. Flyt seksjonene i et varmt bad for å flate dem ut. Plukk opp seksjonene på et glassmikroskopglass. La dem tørke ved RT for å sikre at seksjonene fester seg til lysbildet.
MERK: Bruk lysbilder som eliminerer behovet for å påføre limmaterialer eller proteinbelegg for å forhindre tap av vevsseksjoner under farging.
- Utfør hematoksylin og eosin (H &E) farging.
- Forbered 17 flekker med følgende: xylen (fire retter), 100% etanol (absolutt alkohol) (fire retter), 90% etanol, 80% etanol, 70% etanol, 50% etanol, PBS (tre retter), hematoxylinoppløsning, eosinoppløsning. Overfør lysbildene fra en tallerken til den neste i henhold til trinnene nedenfor, og utfør alt på RT.
MERK: Prosedyren i hver tallerken kan gjentas omtrent 10x (f.eks. Hvis en 20-lysbildeskål brukes, kan 200 flekker gjøres uten å endre væskene). - Deparaffiniser seksjonene ved inkubering ved 65 °C i 30 minutter i inkubatoren. Senk lysbildene i xylen i 30 minutter. Gjenta 1x i ny xylen i 30 min.
- Senk lysbildene i 100% etanol i 5 minutter. Gjenta 1x i ny 100% etanol i 5 min. Senk lysbildene i etanolraden, 90 %, 80 %, 70 % og 50 %, i 2 minutter i hver fortynning.
- Senk lysbildene i fosfatbufret saltvann (PBS) i 5 minutter. Tørk bort overflødig væske fra rundt vevet og baksiden av lysbildene.
- Beis seksjonene i hematoksylinoppløsning (se Materialtabell) i 7-8 minutter. Vask i rennende vann i 30 s fra baksiden for ikke å skade seksjonene. Gjenta trinn 5.3.4.
- Beis seksjonene med eosinoppløsning (se Materialtabell) i 30 s. Vask som nevnt i trinn 5.3.5, og gjenta deretter trinn 5.3.4.
- Senk lysbildene i 100 % etanol (absolutt alkohol) i 2 minutter. Gjenta 1x i ny 100% etanol i 2 min.
- Senk lysbildene i xylen i 5 minutter. Gjenta 1x i ny xylen i 5 minutter.
- La seksjonene lufttørke i 15 minutter ved RT. Legg til en dråpe monteringsmedium (se Materialtabell) på en dekslipp og plasser den deretter øverst i seksjonen.
- Forbered 17 flekker med følgende: xylen (fire retter), 100% etanol (absolutt alkohol) (fire retter), 90% etanol, 80% etanol, 70% etanol, 50% etanol, PBS (tre retter), hematoxylinoppløsning, eosinoppløsning. Overfør lysbildene fra en tallerken til den neste i henhold til trinnene nedenfor, og utfør alt på RT.
- Undersøk seksjonen under et lysmikroskop under en forstørrelse på 20x eller 40x, og ta bilder (figur 7).
6. Vaskulær permeabilitetstest
NOTAT: Alternativt til måling av øretykkelse, kan en vaskulær permeabilitetstest utføres.
- Sensibilisere mus på dag "0" (trinn 3.1.1-3.1.3), og deretter, på dag "4", bedøve musene (trinn 3.2.2) og påfør hapten direkte på ørene (trinn 3.2.4), og utelat 0 timers øremåling.
- Ved 23 timer etter utfordringen, bedøve musene (trinn 3.2.2).
- Injiser intravenøst (i.v.) 8.3 μL / g kroppsvekt på 1% Evans blå fargestoff (se materialtabell) i Dulbeccos fosfatbufrede saltvann (DPBS).
- Bedøve musene igjen- dypbedøvelse (trinn 3.2.2)-1 time etter Evans blå injeksjon.
- Samle ørebiopsier (trinn 4.1).
MERK: Etter denne prosedyren må musene avlives (f.eks. ved cervikal dislokasjon). - Trekk ut fargestoffet fra vevet, plasser ørestans i rørene som inneholder 1 ml formamid, og inkuber ved 37 ° C i atmosfæren på 5% CO2 i 18 timer.
- Sentrifuger biopsiene ved 3000 x g i 3 minutter ved RT. Samle supernatantene med en pipette.
- Mål OD ved en bølgelengde på λ = 565 nm i 96-brønns flatbunnsplater mot et emne som inneholder formamid. Fargen er stabil i 24 timer. Les konsentrasjonen av testprøvene fra standardkurven (bruk konsentrasjonene av Evans blå fra 0,2-30 μg fargestoff / ml formamid) (figur 8).
MERK: Platene må være laget av polypropylen, som har lavere bindingskapasitet, slik at proteiner eller DNA ikke vil binde seg.
7. Serum innsamling og anti-TNP immunglobulin (IgG1) antistoff måling
- Etter å ha samlet ørebiopsier (trinn 4.1), når musen fortsatt er under dyp anestesi, fjern øyebollet med pinsett, legg forsiktig press på musen og samle blod fra retro-orbital sinus inn i røret (hetteglass med gel for å oppnå serum, se Tabell over materialer). En alternativ metode for å samle blod kan være å punktere hjertet med en sprøyte og samle blodet.
MERK: Blodet må samles etter at ørene er fjernet. Den samme blødningsmetoden må brukes over en hel studie på grunn av potensielle forskjeller i blodparametere18. Etter denne prosedyren må mus avlives (f.eks. ved cervikal dislokasjon). - Inverter minimum 6x, vent 30 minutter på at blodet skal koagulere, og sentrifuger deretter ved 1,300-2,000 x g i 10 minutter ved RT.
MERK: Protokollen kan settes på pause her. Prøven er stabil ved −20 °C i 6 måneder. - Coat en 96-brønns flatbunnsplate med 50 μL bovint serumalbumin konjugert med 2,4,6-trinitrophenyl (TNP-BSA) oppløst i DPBS ved konsert på 10 μg / ml. Deretter belegger du den andre platen med bovint serumalbumin (BSA) alene oppløst i DPBS (bakgrunn) i en konsentrasjon på 10 μg / ml. Rug over natten ved 4 °C.
MERK: Museserum inneholder antistoffer (Abs) mot BSA, så prøvene må testes på begge platene, og deretter må en beregning gjøres (OD TNP-BSA - OD BSA). - Vask platene med 300 μL DPBS inneholdende 0,05% Tween 20. Gjenta 3x.
- Klargjør analysefortynningsmiddel (AD): DPBS inneholdende 1 % BSA. Blokker brønnene med AD i 1 time ved RT. Vask igjen (trinn 7.4).
- Forbered en intern standard (iSTD): sensibilisere musene med TNCB (trinn 3.1.1-3.1.3), og 10 dager etter sensibilisering, samle og poll serumet fra alle givere (trinn 7.1 og trinn 7.2).
- Legg til platen 50 μL graderte konsentrasjoner av iSTD fortynnet med AD for å lage standardkurven (beskrevet i tabell 3). Tilsett platen 50 μL serumprøver. Test hver prøve og standardkurve på begge platene (TNP-BSA og BSA-belagt). Inkuber i 2 timer ved RT. Vask platene (trinn 7.4).
- Tilsett 50 μL biotinylert antimus IgG1 monoklonalt antistoff (mAb, se materialtabell) fortynnet 1:250 med AD og inkuber i 1 time ved RT. Vask igjen (trinn 7.4).
- Tilsett 50 μL pepperrotperoksidase streptavidin (HRD streptavidin, se materialtabell) fortynnet 1:2000 med AD, og rug i 30 minutter ved RT i mørket. Vask platen (trinn 7.4).
- Tilsett 50 μL TMB-substrat (se materialtabell) og inkuber i 30 minutter ved RT i mørket.
- Stopp den enzymatiske reaksjonen ved å tilsette 25 μL 1 M H2SO4; reaksjonen er stabil i 30 minutter.
- Mål OD ved en bølgelengde på λ = 450 nm og en bakgrunn på 570 nm (bakgrunnen må trekkes fra hver 450 nm måling). Når du presenterer resultatene, trekker du BSA-målingene fra TNP-BSA for prøver og standardkurven. Deretter beregner du enheten (U) av antistoffer i henhold til standardkurven (figur 9).
8. Adoptiv overføring av CHS-effektorceller
MERK: Denne prosedyren er beskrevet i figur 2.
- Donorer (i forholdet mellom en donor: 1 mottaker): sensibiliserer mus med TNCB på dag "0" (trinn 3.1.1-3.1.3).
- På dag "4", bedøve musens dype anestesi (trinn 3.2.2).
- Isoler med tang de aksillære og inguinal lymfeknuter (ALNs) og milt (SPLs). Samle ALN-ene i ett hetteglass og SPLene i et annet.
MERK: Det er en aksillær lymfeknute bak brystmuskelen i hver aksille. En lyske lymfeknute i hofteregionen ligger ved siden av tre blodårer. Milten ligger på venstre side av kroppen bak tarmen og magen19. Arbeid med sterile verktøy i et biosikkerhetsskap for å opprettholde sterile forhold. Etter denne prosedyren må musene avlives (f.eks. ved cervikal dislokasjon). - Mos vev mellom de frostede endene av to mikroskop lysbilder. Pass cellesuspensjonen gjennom en cellesil med en porestørrelse på 70 μm (se Materialtabell).
- Vask cellene med DPBS supplert med 1% føtalt bovint serum (FBS). Sentrifuge ved 300 x g i 10 min ved 4 °C. Dekanter supernatanten og resuspender den gjenværende cellepelleten i 1-5,0 ml DPBS.
- Tell de levende cellene ved hjelp av et hemocytometer20 med Trypan blå, og bland 10 μL av cellesuspensjonen med 90-990 μL (avhengig av cellenummeret) av Trypan blå. Ta hensyn til fortynningen ved beregning av cellenummeret (10x-100x).
- Forbered en blanding av NN og SPLer (forhold 1: 1): 8,0 x 106 opp til 7,0 x 107 / mus i 200 μL DPBS.
- Mottakere (naive syngeneiske mus): bedøver naive mottakermus (trinn 3.2.2) og injiserer intravenøst med en tilberedt blanding av CHS-effektorceller (trinn 8.7). I kontrollgruppen av mus må du ikke injisere noen celler.
- Mål øretykkelsen før (0 timer) og etter (24 timer) utfordringen (trinn 3.2.1-3.2.6) (figur 10).
- I tillegg utfører du tester på isolerte CHS-effektorceller (f.eks. cellefenotyping eller måling av produserte cytokiner av CHS-effektorceller ved flowcytometri). Cellekulturer kan også etableres, og CHS-effektorcellenes evne til å proliferere i nærvær av antigenet eller mengden utskilte cytokiner i kultursupernatantene kan vurderes21,22 (data ikke presentert).
MERK: Å utføre ytterligere tester krever tilsvarende flere celledonorer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
For CHS-induksjon ble dyrene sensibilisert via hudmaling (abdominal) med 150 μL 5% TNCB eller humbug sensibilisert med kjøretøyet alene. På dag "4" ble ørehevelsesresponsen i begge ørene indusert av kontaktmaling (utfordring) med 10 μL på 0,4% TNCB hos begge musene som tidligere var kontakt sensibilisert med TNCB (testgruppe) og kontrollgruppen mus (humbug sensibilisert). De presenterte dataene viser at musene sensibiliserte med TNCB og utfordret 4 dager senere utviklet betydelig økt ørehevelse sammenlignet med de humbug-sensibiliserte som ble utfordret på samme måte (figur 3, tabell 2, test vs. kontrollgruppe). Ørehevelsesresultatene ble fullstendig validert i videre studier, og fremhevet at en økning i øreødem bestemt med mikrometer var enig med forstørret ørevekt (figur 4), MPO-aktivitet (figur 5), IFN-γ konsentrasjon i øreekstraktene (figur 6), økt fortykkelse av edematøs dermis ved histologisk undersøkelse (figur 7) og øre vaskulær permeabilitet (figur 8 ). Det ble også funnet en økning i konsentrasjonen av TNP-spesifikke IgG1-antistoffer i sera hos testmusene sammenlignet med kontrolldyrene (figur 9).
Som et eksempel på T-cellemediert immunrespons kan CHS også overføres til naive syngeneiske mottakermus. Donorer ble sensibilisert ved bruk av TNCB, og deretter ble CHS-effektorcellene administrert i.v. inn i de naive mottakermusene, som ble utfordret med hapten og testet for CHS 24 timer senere (figur 10). Dyrene som mottok CHS-effektorceller fra donorer som tidligere var sensibilisert med TNCB, viste signifikant økt ørehevelse sammenlignet med dyr som bare ble utfordret (mottok ingen celler).
CHS-reaksjonen har en kompleks mekanisme og involverer forskjellige celler. Antigenpresentasjon og T/B-celleaktivering forekommer i perifere lymfeorganer (f.eks. ALEN og SPL). Det ble fastslått at CHS-effektorceller utarmet av CD4+- celler, men ikke CD8+- celler før adoptivcelleoverføring resulterte i fravær av CHS-reaksjonen hos mottakermusene. Disse cellene ble funnet å være positive for IFN-γ (T-box transkripsjonsfaktor TBX21, Tbet +) og IL-17A (retinsyrereseptorrelatert foreldreløs nukleær reseptor gamma, RORγT +) (Supplerende figur 1).
De presenterte resultatene fra de representative forsøkene ble utført på C57BL/6 og CBA/J hann- og hunnmus ved 8-12 ukers alder. Etter 3R-reglene for bruk av dyr23, spesielt reduksjon, i denne artikkelen, vises resultatene av eksperimenter på små grupper av dyr. Data i grafene er vist som gjennomsnitt ± SEM. Statistisk signifikans ble satt til p < 0,05. Grafene ble tegnet ved hjelp av Prism programvare (se Materialtabell).

Figur 1: Induksjon av CHS. Sensibilisering, utfordring og øremåling. Forkortelser: CHS = kontakt overfølsomhetsreaksjon; TNCB = 2,4,6-trinitroklorbenzen. Klikk her for å se en større versjon av denne figuren.

Figur 2: Adoptivoverføring av CHS-effektorceller. Forkortelser: ALNs = aksillær og inguinal lymfeknuter; CHS = kontakt overfølsomhetsreaksjon; i.v. = intravenøst; SPLs = milt; TNCB = 2,4,6-trinitroklorbenzen. Klikk her for å se en større versjon av denne figuren.

Figur 3: Representativ evaluering av CHS til TNCB ved måling av ørehevelse med mikrometer. Mus ble TNCB (testgruppe) eller humbug (kontrollgruppe) sensibilisert og deretter utfordret. Tykkelsen på auricleen ble målt før og etter utfordringen, og forskjeller i ørehevelse ble beregnet ved å trekke 0 timers øretykkelse (μm) fra 24 timers øretykkelse (μm). Hevelse i øret ble uttrykt som gjennomsnittlig ± SEM, ****p < 0,0001, n = 10 mus/gruppe (data fra tabell 2). Forkortelser: CHS = kontakt overfølsomhetsreaksjon; SEM = standardfeil av gjennomsnittet; TNCB = 2,4,6-trinitroklorbenzen. Klikk her for å se en større versjon av denne figuren.

Figur 4: Representativ evaluering av CHS ved måling av ørevekt. Ørevekt er en av parametrene som tilsvarer ørehevelse. Mus ble TNCB (testgruppe) eller humbug (kontrollgruppe) sensibilisert og deretter utfordret. Ved 24 timer etter utfordringen ble det tatt slag med en diameter på 6 mm fra de fjernede ørene. Stansene ble veid på en analytisk laboratoriebalanse. Ørevekt ble uttrykt i milligram (mg) som gjennomsnittlig ± SEM, *** p < 0,001, n = 10 mus / gruppe. Forkortelser: CHS = kontakt overfølsomhetsreaksjon; SEM = standardfeil av gjennomsnittet; TNCB = 2,4,6-trinitroklorbenzen. Klikk her for å se en større versjon av denne figuren.

Figur 5: Representativ evaluering av MPO-aktivitet. Økt MPO-aktivitet i vevsekstrakter korrelerer med ørebetennelse. TNCB-sensibiliserte mus (testgruppe) og humbug-sensibiliserte mus (kontrollgruppe) ble utfordret. Ved 24 timer etter utfordringen ble ørene fjernet, og 6 mm diameter slag i øret ble ekstrahert og behandlet. MPO-aktivitet uttrykkes i U per proteininnhold (U/g protein). Resultatene vises som gjennomsnittlig ± SEM, **p < 0,01, n = 5-6 mus/gruppe. Forkortelser: CHS = kontakt overfølsomhetsreaksjon; MPO = myeloperoksidase; SEM = standardfeil av gjennomsnittet; TNCB = 2,4,6-trinitroklorbenzen; U = enheter. Klikk her for å se en større versjon av denne figuren.

Figur 6: Representativ evaluering av cytokinproduksjon-IFN-γ konsentrasjon i øreekstrakter. Mus ble TNCB (testgruppe) eller humbug (kontrollgruppe) sensibilisert og deretter utfordret. Ved 24 timer etter utfordringen ble ørene fjernet, og 6 mm diameter slag av øret ble tatt. Konsentrasjonen av IFN-γ ble bestemt i vevshomogenater av ELISA. Resultater vist som gjennomsnittlig ± SEM, *p < 0,05, n = 5 mus/gruppe. Forkortelser: CHS = kontakt overfølsomhetsreaksjon; IFN-γ = interferon gamma; SEM = standardfeil av gjennomsnittet; TNCB = 2,4,6-trinitroklorbenzen. Klikk her for å se en større versjon av denne figuren.

Figur 7: Representativ histologi av ørevevet. Hematoxylin og eosinfarging. Mus ble TNCB (testgruppe) eller humbug (kontrollgruppe) sensibilisert og deretter utfordret. (A-C) Histologisk undersøkelse i testgruppen manifestert i en signifikant økt konsentrasjon av inflammatoriske celler (mononukleære og polymorfonukleære celler), hovedsakelig i dermis, med mikroabscessdannelse i epidermis. Fortykkelse av edematøs dermis og en fortykket, hyperplastisk epidermis ble også lagt merke til. (D-E) Kontrollgruppe. Klikk her for å se en større versjon av denne figuren.

Figur 8: Representativ vaskulær permeabilitetstest. Observert ørevevsødem er et resultat av økt vaskulær permeabilitet. For å bestemme endringer i vaskulær permeabilitet ble mus TNCB (testgruppe) eller humbug (kontrollgruppe) sensibilisert og deretter utfordret 4 dager senere. 23 timer etter utfordringen ble Evans blå injisert, og 1 time etter Evans blå injeksjon ble dyrene avlivet, og 6 mm diameter slag i øret ble laget. Resultater vist som gjennomsnittlig ± SEM, **p < 0,01, n = 5 mus/gruppe. Forkortelser: CHS = kontakt overfølsomhetsreaksjon; SEM = standardfeil av gjennomsnittet; TNCB = 2,4,6-trinitroklorbenzen. Klikk her for å se en større versjon av denne figuren.

Figur 9: Representativ anti-TNP IgG1 antistoffmåling. Konsentrasjonen av anti-TNP IgG1 antistoffer i serum ble målt 24 timer etter utfordringen med hapten TNCB i humbug sensibilisert (kontroll) og i TNCB-sensibiliserte (testgruppe) mus. Den innsamlede sera ble testet for antistoffkonsentrasjon av ELISA. Resultater vist som gjennomsnittlig ± SEM, ***p < 0,001, n = 10 mus/gruppe. Forkortelser: CHS = kontakt overfølsomhetsreaksjon; IgG1 = immunglobulin G subklasse 1; SEM = standardfeil av gjennomsnittet; TNCB = 2,4,6-trinitroklorbenzen. Klikk her for å se en større versjon av denne figuren.

Figur 10: Representativ adoptivoverføring av CHS-effektorcellene. CHS-effektorcellene ble hentet fra donorer som ble sensibilisert med TNCB. Deretter ble de innsamlede immuncellene injisert, dvs. i naive syngeneiske mottakere, som ble utfordret for å fremkalle CHS-effektorfasen. Kontrollgruppen av mus fikk ingen celler før utfordringen. Tykkelsen på auricleen ble målt før og etter utfordringen. Resultater vist som gjennomsnittlig ± SEM, ***p < 0,001, n = 7 mus/gruppe. Forkortelser: CHS = kontakt overfølsomhetsreaksjon; SEM = standardfeil av gjennomsnittet; TNCB = 2,4,6-trinitroklorbenzen. Klikk her for å se en større versjon av denne figuren.
| Musestamme | Sensibiliseringsløsning (dose) på barbert mage |
Elicitation oppløsning (dose) på begge sider av øret/s |
Sensibilisering / elicitation dag | Refs | |||||||||||
| BALB/c (H-2d); C57BL/6 (H-2b) TCRδ-/-, β2m-/-, CD1d-/- (B10 PL (H-2u bakgrunn) |
25 μL av 0,5 % DNFB i aceton-olivenoljeblanding (forholdet 4:1) | 5 μL på 0,1 % DNFB i aceton-olivenoljeblanding (forholdet 4:1) | 0 / 5 | 22 | |||||||||||
| C57BL/6 (H-2b) | 50 μL av 0,5 % DNFB i aceton-olivenoljeblanding (forhold 4:1) | 25 μL av 0,2 % DNFB i aceton-olivenoljeblanding (forholdet 4:1) | 0 / 5 | 32 | |||||||||||
| C57BL/6 (H2b); IL-17A-/- (C57BL/6 bakgrunn) | 150 μL på 5% TNCB i aceton-etanolblanding (forholdet 1:3) | 10 μL 0,4 % TNCB i olivenolje-acetonblandingen (forholdet 1:1) | 0 / 4 | 33 | |||||||||||
| CBA/J (H-2k); C57BL/6 (H-2b) TLR2-/-, MyD88-/-, IL-17A-/- (C57BL/6 bakgrunn) |
150 μL 5 % TNP-Cl (TNCB) i en aceton-etanolblanding (forhold 1:3) | 10 mikroliter 0,4 % TNP-Cl (TNCB) i blanding av olivenolje og aceton (forhold 1:1) | 0 / 4 | 21 | |||||||||||
| C57BL/6 (H-2b); BALB/c (H-2d) | 25 μL av 1 % TNCB i en aceton | 10 mikroliter 0,1 eller 0,2 % TNCB i aceton (og høyere opptil 1 %) | 0 / 7 | 34 | |||||||||||
| C57BL/6 (H-2b); TLR2-/-/ TLR4-/- (dobbel-knockout mus på C57BL/6 bakgrunn) |
100 μL av 3 % TNCB i en aceton | 20 μL 1 % TNCB i aceton (like på baksiden av ørene) | 0 / 5 | 31 | |||||||||||
| C57BL/6 (H-2b) MHC klasse II-mangelfulle mus (C57BL/6 bakgrunn) |
100 μL av 3 % TNCB i aceton-olivenoljeblanding (forholdet 4:1) | 20 μL 0,5 eller 1 % TNCB i aceton-olivenoljeblanding (forholdet 4:1) | 0 / 6 | 35 | |||||||||||
| C57BL/6 (H-2b) | 100 μL av 7 % TNCB i en aceton | 20 μL 1 % TNCB i en aceton | 0 / 5 | 36 | |||||||||||
| C57BL/6 (H-2b) | 100 μL 3 % OX i etanol | 20 μL 1 % OX i en etanol | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/6 bakgrunn) | 25 μL av 0,5 % DNFB i aceton-olivenolje (forhold 4:1) | 10 μL på 0,2 % DNFB i aceton-olivenolje (forhold 4:1) | 0 / 5 | 10 | |||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/6 bakgrunn) | 150 μL av 3 % OKS i alkohol-aceton (forhold 3:1) | 10 μL 1% OX i alkohol-aceton (forhold 3:1) | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); C3H/HeN (H-2k); TLR4-/- (C3H/HeJ bakgrunn); MyD88-/- (C57BL/6 bakgrunn) | 100 mg/ øre av 10 % NiCl2 i hvit petrolatum på dorsalsiden av begge ørene | 10 % NiCl2 i hvit petrolatum | 0,1,2 / 23, 24 | 37 | |||||||||||
| NOD (H-2g7) MyD88-/- (NOD bakgrunn) | 400 μL av 0,5 % FITC i aceton og dibutylftalat | 10 μL av 0,1 % FITC i aceton og dibutylftalat | 0 / 5 | 25 | |||||||||||
Tabell 1: Sammenligning av CHS-modellen i ulike studier. Forkortelser: DNFB = 1-fluoro-2,4-dinitrobenzen; FITC = fluoresceinisotiocyanat; NiCl2 = nikkel (II) klorid; TNCB = 2,4,6-trinitroklorbenzen; TNP-Cl = trinitrophenylklorid; OX = oksazolon. Vennligst klikk her for å laste ned denne tabellen.
| Kontrollgruppe (negativ) | Testgruppe (CHS-reaksjon) | ||||||
| Mus # øre: L, R | 0 timers øretykkelse [μm] | 24 timers øretykkelse [μm] | 24 timer– 0 timer øretykkelse [μm] | Mus # øre: L, R | 0 timers øretykkelse [μm] | 24 timers øretykkelse [μm] | 24 timer– 0 timer øretykkelse [μm] |
| 1 L | 365 | 380 | 15 | 1 L | 345 | 427.5 | 82.5 |
| 1 R | 335 | 380 | 45 | 1 R | 340 | 455 | 115 |
| 2 L | 345 | 355 | 10 | 2 L | 355 | 475 | 120 |
| 2 R | 327.5 | 352.5 | 25 | 2 R | 342.5 | 457.5 | 115 |
| 3 L | 340 | 370 | 30 | 3 L | 340 | 460 | 120 |
| 3 R | 325 | 355 | 30 | 3 R | 345 | 495 | 150 |
| 4 L | 335 | 380 | 45 | 4 L | 357.5 | 432.5 | 75 |
| 4 R | 340 | 350 | 10 | 4 R | 335 | 402.5 | 67.5 |
| 5 L | 350 | 380 | 30 | 5 L | 335 | 387.5 | 52.5 |
| 5 R | 337.5 | 360 | 22.5 | 5 R | 335 | 425 | 90 |
| 6 l | 335 | 365 | 30 | 6 l | 350 | 430 | 80 |
| 6 R | 340 | 375 | 35 | 6 R | 342.5 | 405 | 62.5 |
| 7 l | 345 | 337.5 | 0 | 7 l | 340 | 502.5 | 162.5 |
| 7 R | 345 | 335 | 0 | 7 R | 327.5 | 447.5 | 120 |
| 8 l | 370 | 380 | 10 | 8 l | 327.5 | 515 | 187.5 |
| 8 R | 375 | 355 | 0 | 8 R | 327.5 | 540 | 212.5 |
| 9 l | 385 | 370 | 0 | 9 l | 330 | 415 | 85 |
| 9 R | 342.5 | 362.5 | 20 | 9 R | 327.5 | 390 | 62.5 |
| 10 l | 307.5 | 340 | 32.5 | 10 l | 337.5 | 445 | 107.5 |
| 10 R | 325 | 350 | 25 | 10 R | 352.5 | 455 | 102.5 |
| Bety | 20.75 | Bety | 108.5 | ||||
| ± SEM | 3.245 | ± SEM | 9.565 | ||||
Tabell 2: Representativt eksempel på beregning av forskjellen i øretykkelse i effektorfasen av CHS. Beregning av forskjellen i tykkelsen på auricleen før og etter utfordringen med hapten: 24 timers øretykkelse (μm) - 0 timers øretykkelse (μm). Hvert øre teller som en separat måling. Ørehevelse uttrykt i mikrometer (μm) ± SEM, n = 20. Forkortelser: L = venstre; R = høyre. Vennligst klikk her for å laste ned denne tabellen.
| iSTD-fortynning med AD | anti-TNP IgG1 Ab (U/ml) |
| 100 ganger | 250 |
| 200 ganger | 125 |
| 400 ganger | 62.5 |
| 800 ganger | 31.25 |
| 1600 ganger | 15.63 |
| 3200 ganger | 7.8 |
| bare AD | 0 |
Tabell 3: Fremstilling av de forskjellige konsentrasjonene av iSTD for standardkurven for anti-TNP IgG1 Ab-måling. 100x iSTD-fortynningen ble antatt å være 250 U anti-TNP IgG1 Ab. Forkortelser: Ab = antistoff; AD = analyse fortynningsmiddel; iSTD = intern standard; IgG1 = immunglobulin G subklasse 1; TNP = 2,4,6-trinitrophenyl; U = enheter. Vennligst klikk her for å laste ned denne tabellen.
Supplerende figur 1: Fenotypen av CHS-effektorceller. CHS-effektorcellene ble hentet fra donorers ALN og SPLer, som tidligere ble sensibilisert med TNCB. (A) Ved å bruke MACS-teknikken ble CHS-effektorcellene (hele NN og SPLer) tømt for enten CD4 + eller CD8 + -celler. Deretter ble adoptivcelleoverføring utført før fremkalling av CHS-effektorfasen. Ørehevelse ble uttrykt som gjennomsnittlig ± SEM (B-E) Ved hjelp av flowcytometriteknikk ble CHS-effektor og naive (hentet fra naive mus) celler farget for IFN-γ, Tbet, IL-17A og RORγt før analysen. Celler ble inngjerdet for TCRβ + CD4 + populasjonen. Resultater vist som gjennomsnittlig ± SEM, ***p < 0,001, **p < 0,01, * p < 0,05, n = 4-6 mus/gruppe. Forkortelser: ALNs = aksillær og inguinal lymfeknuter; CD4 = klynge av differensiering 4; CHS = kontakt overfølsomhetsreaksjon; IFN-γ = interferon gamma; IL = interleukin; MACS = magnetisk aktivert cellesortering; ns = ikke signifikant; RORγt = retinsyre-reseptor-relatert foreldreløs nukleær reseptor gamma; SEM = standardfeil av gjennomsnittet; SPLs = milt; Tbet = T-box transkripsjonsfaktor TBX21; TCRβ = T-celle reseptor beta; TNCB = 2,4,6-trinitroklorbenzen. Vennligst klikk her for å laste ned denne filen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
CHS induseres via haptens, som binder seg til selvproteinantigener i huden og danner neoantigener. CHS medieres av lokal ekstravaskulær rekruttering av sirkulerende antigenspesifikke CHS-effektor T-celler, noe som resulterer i hevelse i det utfordrede vevet, med en topp på 24 timer etter eksponering av sekundærhuden for samme hapten6. Hevelsen i vevet skyldes hovedsakelig infiltrasjon av leukocytter og leukocyttavhengig fibrinavsetning24. Disse endringene kan oppdages med et mikrometer som måler ørehevelsen av hapten-sensibiliserte og utfordrede versus humbug-sensibiliserte og utfordrede mus.
CHS kan også bestemmes ved sammenligning av ørevekt. Deretter kan ørestansene som brukes til bestemmelse av ørevekt, brukes til ytterligere tester. Celleinfiltrene i de betente ørene består av cytokinproduserende T-lymfocytter og MPO-positive nøytrofiler. I ørevevshomogenatene kan forskjellige parametere måles, for eksempel MPO-aktivitet eller konsentrasjonen av proinflammatoriske cytokiner (f.eks. TNF-α, IFN-γ, IL-17A eller andre) ved hjelp av ELISA-testen eller uttrykket av cytokin mRNA i huden ved hjelp av qPCR-test25. I tillegg kan endringer i fartøyets permeabilitet evalueres ved hjelp av Evans blå test21,26.
I det betente ørevevet kan de observerte endringene også suppleres med in vitro-tester, som fremhever T-celleproliferasjon og cytokinproduksjon. Dette kan lett oppnås ved å dyrke ALNer i nærvær av hapten-konjugerte proteinantigener22,27. Evalueringen av cytokinsekresjon av ALN isolert fra sensibiliserte, men ikke utfordrede mus gir detaljer om cytokinproduksjon av CHS-effektorcellene i stedet for induksjonen.
Begrensninger
Mange mikrometer måler ørehevelse med forskjellig nøyaktighet. For eksempel utøves det laveste trykket av en fjærkaliper, så det ser ut til at resultatene best vil gjenspeile den faktiske tykkelsesmåleren. Imidlertid vil mikrometer som utøver mer trykk, som Mitutoyo, sannsynligvis komprimere tettere væsken som akkumuleres i ørene i den tidlige fasen av ødemdannelse. Den bifasiske naturen til CHS kan visualiseres tydeligere ved hjelp av slike mikrometer fordi mer trykk utøves. Dette er vanskeligere når du bruker en fjærkaliper med lett trykk28. Likevel ble tykkelsen på ørene i noen studier målt med en tykkelse29. Observatørens erfaring sikrer også nøyaktige målinger, som kan påvirkes av subjektive følelser, selv om observatøren ikke er klar over eksperimentelle grupper.
Alternative metoder er beskrevet her som kan bidra til å bekrefte målingene av ørehevelse med et mikrometer, noe som gjør dataene presentert mer pålitelige og mindre subjektive. Disse alternative strategiene for vurdering av CHS kan imidlertid bare brukes på et tidspunkt. Mikrometermålinger kan gjentas på forskjellige tidspunkter, noe som gjør det mulig å studere CHS-kinetikken.
Endringer
Protokollen for å studere CHS-reaksjonen vi bruker i vårt laboratorium, skiller seg vesentlig fra de som brukes i andre laboratorier, inkludert dosen av hapten og løsningsmiddelsammensetningen som brukes til både fremkalling og sensibilisering, samt tidspunktet hvor reaksjonen vurderes. Øretykkelsen kan måles ved forskjellige tidspunkter (f.eks. 2 timer, 24 timer, 48 timer og 72 timer etter utfordringen)10,30. Tabell 1 viser ulike eksperimentelle modeller, spesielt forskjellene i dyrestamme, hapten og sensibiliserings-/smittetider brukt i ulike studier 10,21,22,26,31,32,33,34,35,36,37 . CHS-protokollen kan også utføres uten tidligere barbering av musens underliv.
Den neste forskjellen gjelder utførelsen av selve fremkallingen (utfordringen). Som det er typisk, gjøres sensibiliseringen ved å male barberte mus magehud med hapten eller kjøretøyet alene. Deretter utfordres det ene øret i begge gruppene med fortynnet hapten på hver øreside. Som en kontroll er det motsatte øret malt med en identisk mengde kjøretøy alene10,31.
Kritiske trinn
Det mest kritiske øyeblikket er å utløse CHS, da testresultatene avhenger av det. (1) Hapten-løsningen er svært flyktig og lysfølsom, så den må være tett lukket og beskyttet mot lys, og når den er i bruk, må den raskt påføres dyrenes hud slik at den ikke fordamper. (2) Etter å ha påført hapten på bukets hud, må den tørkes før dyret kommer tilbake til buret fordi mus kan smøre det mot sengetøyet eller påføre det på ørene med potene (da kan målingen av tykkelsen på auricleen være utilstrekkelig). (3) Ulike metoder for merking av dyr, for eksempel merking av musehaler med en løsningsmiddelresistent markør, er også kjent. Imidlertid kan fargestoffene som er tilstede i markøren (ikke studert) bli en hapten og utløse CHS. Derfor ble det i denne studien valgt en merkingsmetode som ikke påvirker reaksjonen. (4) Å velge en barberingsmetode er veldig viktig, da det kan irritere huden. I denne protokollen ble en grå såpe brukt fordi den har beroligende egenskaper; det akselererer behandlingen av mindre kutt og festering sår, noe som er hjulpet av dets antibakterielle effekter. Det beroliger hevelse og betennelse i huden.
Videre undersøkelser og standardisering av eksperimentelle prosedyrer, inkludert dyrebruk (stamme og kjønn), er nødvendig for å sammenligne resultatene fra ulike studier.
Mange ulike miljøfaktorer og nye stoffer med biologiske funksjoner kan testes i CHS-modellen. Denne modellen kan være nyttig hvis forskere vil vise om testede faktorer modulerer T-celleavhengige immunresponser.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne har ingenting å avsløre.
Acknowledgments
Denne studien ble støttet av subvention SUBZ. A020.22.060 fra Medical University i Wroclaw, Polen, og ved tilskudd fra departementet for vitenskap og høyere utdanning N N401 545940 til MS og IP2012 0443 72 til MMS.
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
Immunologi og infeksjon utgave 187 Murine modell allergisk kontakteksem (ACD) kontakt overfølsomhet (CHS) øre hevelse vaskulær permeabilitet myeloperoksidase (MPO) cytokiner 2,4,6-trinitroklorbenzen (TNCB) haptenErratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
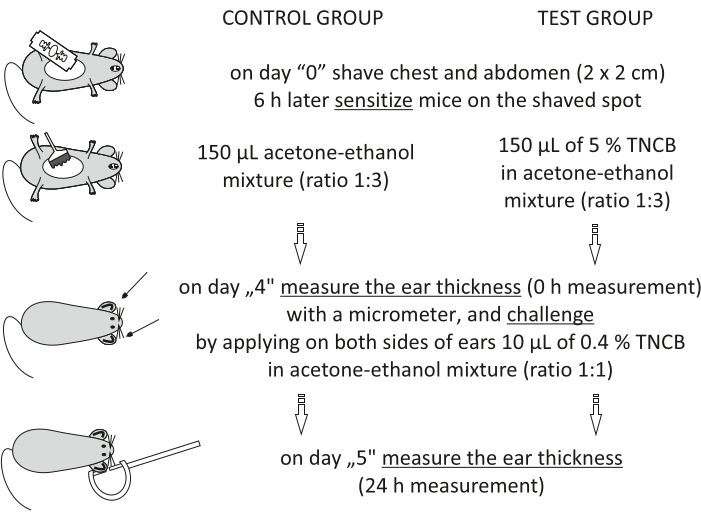
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
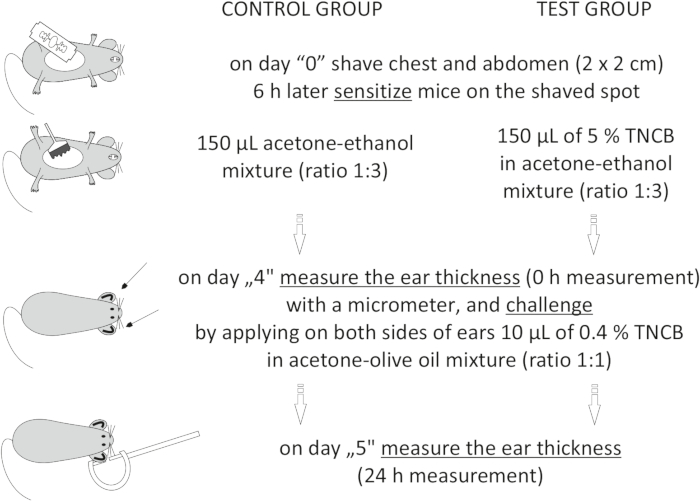
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
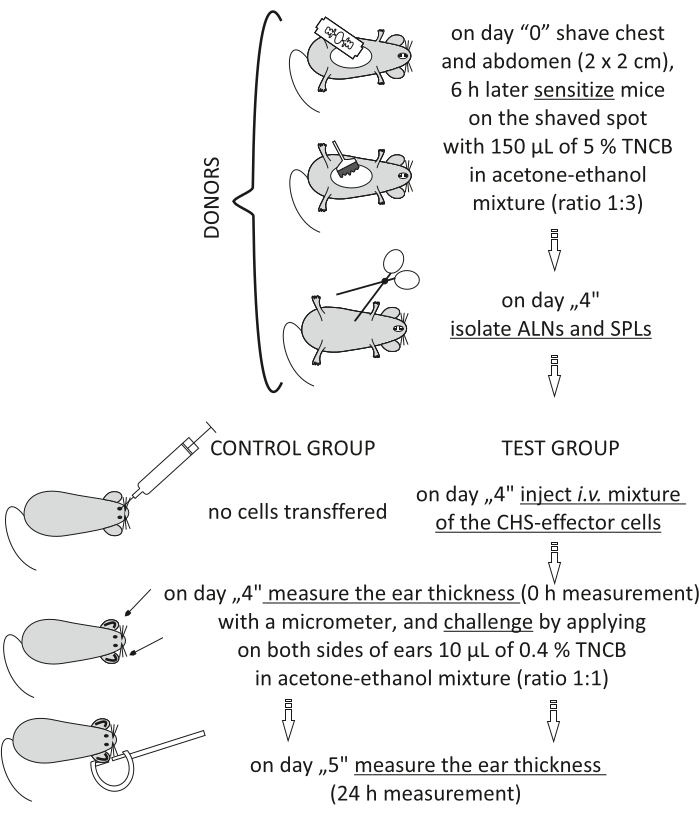
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
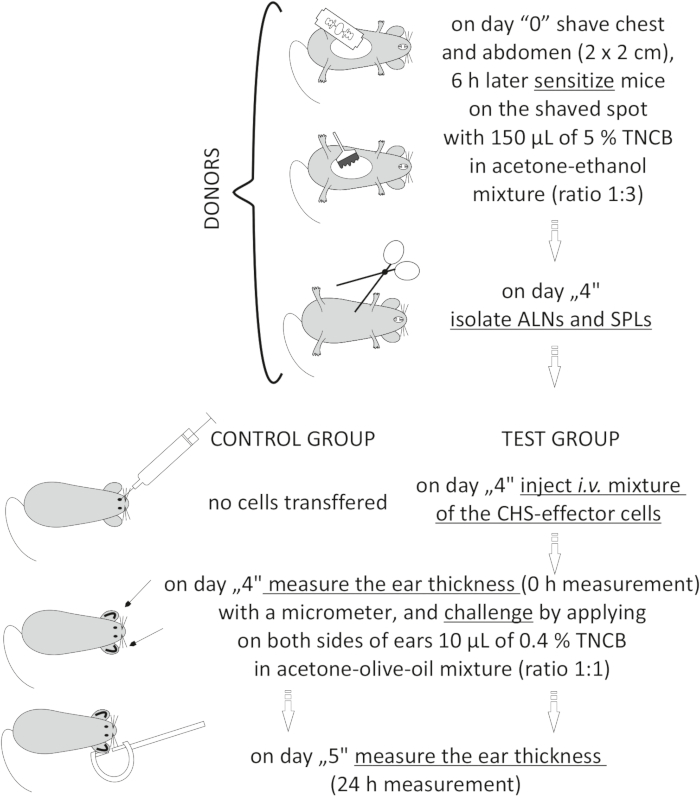
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



