ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
Kontaktöverkänslighet (CHS) är en murin experimentell modell av allergisk kontaktdermatit (ACD). CHS bygger på sensibilisering med reaktiv hapten genom att måla den rakade huden på bröstet och buken, med en efterföljande öronhudsutmaning med en utspädd hapten, vilket orsakar en svullnadsreaktion som bedöms på olika sätt.
Abstract
Kontaktöverkänslighet (CHS) är en experimentell modell av allergisk kontaktdermatit (ACD) som kan studeras hos möss. Denna studie syftar till att presentera en objektiv laboratoriemetod som kan hjälpa till att studera CHS-reaktionen hos möss, som kan mätas och kvantifieras med olika tester. För att inducera CHS, på dag "0", sensibiliserades möss på en tidigare rakad plats genom bukhudmålning med hapten 2,4,6-trinitroklorbensen (TNCB) i en aceton-etanolblandning, medan negativa kontrollmöss var bluffsensibiliserade med fordonets enda-aceton-etanolblandning. På dag "4" mättes baslinjens örontjocklek med en mikrometer före elicitering av CHS (utmaning) genom att måla båda öronen med utspädd TNCB både i test- och kontrollgrupperna. Efter 24 h mättes öronsvullnaden med en mikrometer. CHS är ett exempel på ett T-cellsmedierat immunsvar som orsakar svullnad i inflammerad vävnad, som toppar 24 timmar efter hudutmaningen med samma hapten. En ökning av öronödem korrelerat med ökad öronvikt, myeloperoxidas (MPO) aktivitet, proinflammatorisk cytokinkoncentration i öronextrakten, ökad förtjockning av edematös dermis i den histologiska undersökningen och öron vaskulär permeabilitet. Det fanns också en ökning av koncentrationen av TNP-specifika IgG1-antikroppar i serum i testgruppen jämfört med kontrollmössen. Dessutom kan CHS framgångsrikt överföras med CHS-effektorceller erhållna från givare som tidigare sensibiliserats med TNCB. CHS-effektorcellerna administrerades intravenöst till naiva mottagarmöss, som därefter utmanades med samma utspädda hapten. Öronsvullnad mättes med en mikrometer 24 timmar senare.
Introduction
Allergisk kontaktdermatit (ACD) är en vanlig hudinflammatorisk sjukdom i industrialiserade länder orsakad av en överkänslighetsreaktion av typ IV till följd av exponering för kemikalier med låg molekylvikt som kallas haptens. De ämnen som orsakar kontaktsensibilisering hos människor inkluderar tungmetalljoner (krom, nickel, järn, kobolt), terpentin, dofter, färgämnen och konserveringsmedel som finns i kosmetika (t.ex. p-fenylendiamin), vissa läkemedel (t.ex. neomycin, bensokain), β-laktamantibiotika (dvs penicillin), kemikalier som produceras av växter (pentadekatekol, ett ämne som finns i giftig murgröna), samt hydrokinon som används i fotografisk industri 1,2 . ACD-etiologiska medel är mycket höga eftersom över 100 000 kemikalier används bara inom industrin och 2 000 nya syntetiseras varje år. Hittills har mer än 3 700 molekyler identifierats som kan vara kontakthaptens/allergener3. Kontaktöverkänslighetsreaktionen (CHS) är en experimentell modell av ACD som kan studeras hos möss, marsvin och råttor och kan induceras genom topisk hudapplikation av reaktiva kemiska haptens upplösta i organiska lösningsmedel 4,5,6. Denna studie syftar till att beskriva en objektiv laboratoriemetod som kan hjälpa till att studera CHS-reaktionen hos möss, som kan mätas och kvantifieras med olika tester.
CHS består av sensibiliseringsfaser (induktion) och effektorfaser (utmaning). I djurmodeller binder haptens först kovalent till proteiner i kroppen för att skapa neoantigens. Under sensibiliseringsfasen främjar aktiverade keratinocyter migration och mognad av huddendritiska celler (sDC) genom att producera proinflammatoriska cytokiner-tumörnekrosfaktor α (TNF-α) och interleukin 1β (IL-1β)7. Epidermala Langerhans-celler (LCs) presenterar antigener under CHS-induktions- och effektorfaserna8. LCs utsatta för hapten under sensibilisering främjar induktion av både regulatoriska och effektorceller9. Ökande bevis från flera studier tyder på att CHS-svar kan förmedlas av antingen CD4 + MHC klass II-begränsade Th1-celler, som lokalt frigör interferon-γ (IFN-γ) för att använda ett karakteristiskt inflammatoriskt infiltrat, CD8 + MHC klass I-begränsade Tc1-lymfocyter som också kan frigöra IFN-γ men mestadels förmedla cytotoxiska skador på keratinocyter, och nu också interleukin 17 (IL-17) -producerande Th17-celler10, 11.
Flera olika CHS-modeller som använder olika arter1 2,13,14 och haptens har utvecklats (en detaljerad jämförelse av olika haptens, lösningsmedel och appliceringstid sammanfattas i tabell 1). Musen, en ofta använd laboratorieart, erbjuder några fördelar med att studera CHS. Det finns fler stammar, knockouts (KO) och transgena djur bland möss jämfört med andra arter, vilket gör dem till ett mycket attraktivt djur15. Dessutom kräver CHS-modellen många djur, och möss är mer ekonomiska här. Djurmodeller efterliknar inte ACD i alla aspekter; i synnerhet visar de skorpbildning och desquamation, vilket inte är vanligt för människor 16,17. Egenskaperna hos kronisk sjukdom är utmanande att reproducera, främst för att den beskrivna modellen inte antar appliceringen av hapten under en lång tidsperiod. Det har dock bekräftats här att många av de väsentliga aspekterna av ACD reproduceras. Det har också visat sig att, som hos människor, är dessa egenskaper förknippade med lokala allergiska reaktioner. Valet av hapten, dess lösningsmedel och dess tillämpning som beskrivs i detta protokoll dikterades av det faktum att resultaten har bekräftats av många in vitro-tester och att det testades och modifierades i laboratoriet i många år tills den nuvarande versionen fastställdes. Murina modeller möjliggör analys av cellundergrupper eller cytokiner som är involverade i utvecklingen av ACD och är väsentliga för prekliniska bedömningar av nya behandlingar.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Alla experiment som presenteras i denna artikel genomfördes enligt riktlinjerna från den 1: a lokala etiska kommittén för djurförsök i Krakow. Alla beskrivna procedurer utfördes enligt de lokala rekommendationerna, särskilt när det gäller användning av ketamin / xylazin som bedövningsmedel, med båda sidor av öronen för att applicera ämnet / hapten, skära av örat och samla blod genom borttagning av ögongloben. BALB/c (haplotyp H-2d), CBA/J (H-2k) och C57BL/6 (H-2b) han- och honmöss, 6-12 veckor gamla, användes för denna studie (se materialtabell). För statistisk signifikans är det bäst om varje grupp möss består av 10-12 djur.
1. Förberedelse av djur
- Rengör operationsbordet med en 70% etanollösning före och efter alla procedurer. Om du använder möss som kräver sterila förhållanden, utför alla operationer i ett biosäkerhetsskåp.
2. Märkning av möss för identifiering
- Märk mössen genom att raka huden med ett rakblad: #0 - omarkerad, #2 - på höger framtass, #3 - på höger sida, #4 - på höger baktass, #5 - vid svansens botten, #6 - på vänster baktass, #7 - på vänster sida, #8 - på vänster framtass.
OBS: På grund av den inducerade reaktionen kan möss inte märkas klassiskt genom öronstansning eller märkning. Mössen sövdes inte under märkning.
3. Induktion av CHS
OBS: Denna procedur visas i figur 1.
- Utför sensibiliseringen (induktionen) enligt stegen nedan.
- På dag "0", raka möss på bröstet och buken (kvadrat 2 cm x 2 cm) genom att applicera grå tvål med vatten och raka dig med ett rakblad.
OBS: Innan du applicerar hapten, vänta i 6 timmar så att huden inte irriteras. - Bered 5 % hapten: 2,4,6-trinitroklorbensen (TNCB, se materialtabell) i en aceton-etanolblandning (förhållande 1:3) eller enbart vehikel (acetonetanol). Förbered lösningar strax före användning i en glasflaska och skydda den från ljus genom att täcka injektionsflaskan med aluminiumfolie.
- Samma dag sensibiliserar mössen genom att applicera 150 μL 5% hapten på den tidigare rakade platsen. I gruppen kontrollmöss, applicera vehikeln ensam för att bedöma den icke-specifika inflammatoriska reaktionen. Innan du sätter tillbaka djuret i buret, vänta i 30 s och låt hapten torka.
VARNING: Använd handskar; TNCB orsakar en allvarlig allergisk reaktion hos de flesta.
- På dag "0", raka möss på bröstet och buken (kvadrat 2 cm x 2 cm) genom att applicera grå tvål med vatten och raka dig med ett rakblad.
- Utför mätning av elicitering (utmaning) och öronsvullnad.
- På dag "4", förbered 0,4% hapten: TNCB i en aceton-etanolblandning (förhållande 1:1). Förbered lösningen strax före användning i en injektionsflaska av glas och skydda den mot ljus genom att täcka injektionsflaskan med aluminiumfolie.
- Bedöva mössen med en intraperitoneal (i.p.) injektion av en blandning av ketamin (90-120 mg/kg) och xylazin (5-10 mg/kg) (se materialtabell) för djupbedövning. Se till att musen är helt sövd i minst 5 minuter med tå nypa.
- Mät örontjockleken (0 h mätning, baslinje) med en mikrometer (se materialtabell) av en observatör som inte är medveten om experimentgrupperna.
- Applicera 10 μl 0,4% hapten på båda sidor av öronen i båda grupperna (test och kontroll). Innan du sätter tillbaka djuret i buret, vänta i 30 s och låt hapten torka.
- På dag "5", 24 h efter applicering av hapten, upprepa steg 3.2.2-3.2.3 för 24-timmarsmätningen.
- Utvärdera CHS-svaret genom att beräkna skillnaden i örontjocklek före och efter utmaningen med hapten: 24 h örontjocklek (μm) - 0 h örontjocklek (μm). Räkna varje öra som ett separat mått. Uttryck sedan öronsvullnaden i mikrometer (μm) ± medelvärdets medelvärde (SEM) (tabell 2, figur 3).
4. Öronbiopsier
- Direkt efter 24-timmarsmätningen av örontjockleken (när musen fortfarande är under djupbedövning), skär av öronen så nära skallen som möjligt med sax. Samla biopsierna från den distala sidan av öronen genom att göra en stans med en diameter på 6 mm med hjälp av en biopsistans (se materialtabell).
- Mät öronvikten (steg 4.2) och utför dessutom ett av följande tester på samma öronbiopsi: myeloperoxidas (MPO) -analys (steg 4.3) eller in vitro-mätning av cytokinkoncentration i öronextrakt (t.ex. IFN-γ, IL-17A, TNF-α [steg 4.4]).
OBS: Skär öronen innan bloduppsamling. Efter denna procedur måste mössen avlivas (t.ex. genom cervikal dislokation).
- Mät öronvikten (steg 4.2) och utför dessutom ett av följande tester på samma öronbiopsi: myeloperoxidas (MPO) -analys (steg 4.3) eller in vitro-mätning av cytokinkoncentration i öronextrakt (t.ex. IFN-γ, IL-17A, TNF-α [steg 4.4]).
- Mät vikten av varje öronbiopsi på analysbalansen och uttryck den i milligram (mg) (Figur 4).
- Utför en MPO-analys enligt stegen nedan.
- Förbered homogeniseringsbufferten genom att lösa upp 0,5% hexadecyltrimethylammoniumbromid i 50 mmol fosforatbuffert KH2PO4 / Na2HPO4 och justera pH till 6,0 (använd vid rumstemperatur, RT).
- Homogenisera biopsierna i 2 ml mikrocentrifugrör med 500 μl beredd buffert i 10 min med en homogenisator med 5 mm diameter av rostfritt stålpärlor (tillsätt två pärlor / injektionsflaska) (se materialtabell). Kyl sedan ner provet i 15 minuter vid 4 °C och homogenisera det i ytterligare 10 minuter.
OBS: Mikrocentrifugrör har en rund botten så att pärlorna lätt kan röra sig. - Frys homogenaten vid −20 °C i 30 minuter. Tina och virvel (se till att proverna tinas). Upprepa denna procedur 3x.
- Centrifugera homogenaten vid 3 000 x g i 30 minuter vid 4 °C. Skörda supernatanterna med en pipett. Uttryck MPO-aktiviteten i enheter (U) per 1 mg protein.
OBS: Protokollet kan pausas här. Proverna är stabila vid −20 °C i 3 månader. - För att mäta MPO-aktivitet, utför en enzymatisk reaktion genom att blanda 20 μL supernatant och 200 μL MPO-substrat (0,167 mg / ml ortodianindihydroklorid i 50 mmol KH2PO4 / Na2HPO4-buffert med 5 x 10−4% H202) och tillsätt i 96-brunnars plattbottenplattor. Inkubera plattorna i 20 min vid RT.
- Förbered standardkurvan genom att använda 20 μl av MPO-standarden vid koncentrationer från 0,008 U upp till 0,5 U i 200 μL av MPO-substratet. Bered blindprovet enbart med MPO-substratet.
VARNING: Använd en mask när du arbetar med ortodianisindihydroklorid.
OBS: Plattorna måste vara gjorda av polypropen, som har en lägre bindningskapacitet så att proteiner eller DNA inte binder. - Mät den optiska densiteten (OD) vid en våglängd av λ = 460 nm. Den enzymatiska reaktionen är stabil i 10 min. Läs MPO-aktiviteten i testade prover från standardkurvan.
- För att mäta proteinkoncentrationen, använd 20 μL av supernatanten, utför ett test med ett bicinchoninsyrakit för proteinbestämning (se materialtabell) och mät OD vid λ = 562 nm (figur 5).
- Utför in vitro-mätning av cytokiner i öronextraktet.
- Homogenisera öronbiopsierna vid RT i 2 ml mikrocentrifugrör med 500 μL vävnadsproteinextraktionsreagens (T-PER) i 10 minuter med en homogenisator med 5 mm diameter rostfritt stålpärlor (tillsätt två pärlor / injektionsflaska). Kyl sedan ner provet i 15 minuter vid 4 °C och homogenisera det i ytterligare 10 minuter.
OBS: Mikrocentrifugrör har en rund botten så att pärlorna lätt kan röra sig. - Centrifugera homogenaten vid 3 000 x g i 30 minuter vid 4 °C.
OBS: Protokollet kan pausas här. Proverna är stabila vid −80 °C i 6 månader. - Bedöm cytokinnivåerna med hjälp av en kommersiellt tillgänglig ELISA-uppsättning (t.ex. IFN-γ) (se materialtabell) enligt tillverkarens anvisningar (figur 6).
- Homogenisera öronbiopsierna vid RT i 2 ml mikrocentrifugrör med 500 μL vävnadsproteinextraktionsreagens (T-PER) i 10 minuter med en homogenisator med 5 mm diameter rostfritt stålpärlor (tillsätt två pärlor / injektionsflaska). Kyl sedan ner provet i 15 minuter vid 4 °C och homogenisera det i ytterligare 10 minuter.
5. Histologi av öronvävnad
- Direkt efter 24-timmarsmätningen av örontjockleken, när musen fortfarande är djupt sövd, skär av öronen så nära skallen som möjligt med saxen (steg 4.1).
OBS: Efter denna procedur måste mössen avlivas (t.ex. genom cervikal dislokation). - Utför paraffininbäddning av vävnadsblocken enligt stegen nedan.
- Direkt efter borttagning, placera örat i ~ 10 ml 10% formalin i 24 timmar.
- Placera öronen i en vävnadsbehandlingskassett. Placera kassetterna i en automatiserad processor (se materialtabell) för uttorkningscykler (alkohol 70%, 90%, 100%, 30 min vardera vid RT), rensningscykler (xylen 3x, 30 min vardera vid RT) och vaxinfiltrationscykler (paraffin 3x, 30 min vardera vid 56 °C).
- Ta bort kassetterna från den automatiska processorn och håll fast värmeplattan tills det behövs. Fyll vaxformen med varmt vax (från dispensern).
- Ta bort sektionerna från kassetten med uppvärmda pincett och placera dem i formen; Placera sedan kassettbasen på toppen av formen och fyll sedan med mer vax. Lägg den i kylt vatten på en kall platta i 30 minuter så att paraffinet stelnar till ett block som innehåller provet.
- Använd en roterande mikrotom (se materialtabell) för att skära sektioner ~ 5 μm tjocka. Flyt sektionerna i ett varmt bad för att platta dem. Plocka upp sektionerna på ett glasmikroskopglas. Låt dem torka vid RT för att säkerställa att sektionerna fäster vid bilden.
OBS: Använd objektglas som eliminerar behovet av att applicera självhäftande material eller proteinbeläggningar för att förhindra förlust av vävnadssektioner under färgning.
- Utför färgning av hematoxylin och eosin (H&E).
- Förbered 17 färgningsrätter med följande: xylen (fyra rätter), 100% etanol (absolut alkohol) (fyra rätter), 90% etanol, 80% etanol, 70% etanol, 50% etanol, PBS (tre rätter), hematoxylinlösning, eosinlösning. Överför bilderna från en maträtt till nästa enligt stegen nedan och utför allt på RT.
OBS: Proceduren i varje maträtt kan upprepas ungefär 10 gånger (t.ex. om en 20-glidskål används kan 200 fläckar göras utan att vätskorna byts ut). - Deparaffinera sektionerna genom inkubation vid 65 °C i 30 min i inkubatorn. Sänk ner bilderna i xylen i 30 minuter. Upprepa 1x i ny xylen i 30 min.
- Sänk ner bilderna i 100% etanol i 5 minuter. Upprepa 1x i ny 100% etanol i 5 min. Sänk ner objektglasen i etanolraden, 90%, 80%, 70% och 50% i 2 min i varje utspädning.
- Sänk ner objektglasen i fosfatbuffrad saltlösning (PBS) i 5 minuter. Torka bort överflödig vätska från runt vävnaden och baksidan av bilderna.
- Färga sektionerna i hematoxylinlösning (se materialtabell) i 7-8 min. Tvätta i rinnande vatten i 30 s från baksidan för att inte skada sektionerna. Upprepa steg 5.3.4.
- Färga sektionerna med eosinlösning (se materialtabell) i 30 s. Tvätta enligt anvisningarna i steg 5.3.5 och upprepa sedan steg 5.3.4.
- Sänk ner objektglasen i 100 % etanol (absolut alkohol) i 2 minuter. Upprepa 1x i ny 100% etanol i 2 min.
- Sänk ner bilderna i xylen i 5 minuter. Upprepa 1x i ny xylen i 5 min.
- Låt sektionerna lufttorka i 15 min vid RT. Lägg till en droppe monteringsmedium (se materialtabell) på ett täckglas och placera det sedan högst upp på sektionen.
- Förbered 17 färgningsrätter med följande: xylen (fyra rätter), 100% etanol (absolut alkohol) (fyra rätter), 90% etanol, 80% etanol, 70% etanol, 50% etanol, PBS (tre rätter), hematoxylinlösning, eosinlösning. Överför bilderna från en maträtt till nästa enligt stegen nedan och utför allt på RT.
- Undersök sektionen under ett ljusmikroskop under en förstoring på 20x eller 40x och ta bilder (figur 7).
6. Test av vaskulär permeabilitet
OBS: Alternativt till örontjockleksmätning kan ett vaskulärt permeabilitetstest utföras.
- Sensibilisera möss på dag "0" (steg 3.1.1-3.1.3) och sedan, på dag "4", bedöva mössen (steg 3.2.2) och applicera hapten direkt på öronen (steg 3.2.4) och utelämna 0-timmars öronmätning.
- Vid 23 h efter utmaningen, bedöva mössen (steg 3.2.2).
- Injicera intravenöst (i.v.) 8,3 μl/g kroppsvikt av 1% Evans blå färgämne (se materialtabell) i Dulbeccos fosfatbuffrade saltlösning (DPBS).
- Bedöva mössen igen-djup anestesi (steg 3.2.2)-1 h efter Evans blå injektion.
- Samla öronbiopsier (steg 4.1).
OBS: Efter denna procedur måste mössen avlivas (t.ex. genom cervikal dislokation). - Extrahera färgämnet från vävnaden, placera öronstansar i rören som innehåller 1 ml formamid och inkubera vid 37 °C i atmosfären av 5%CO2 i 18 timmar.
- Centrifugera biopsierna vid 3 000 x g i 3 min vid RT.
- Mät OD vid en våglängd av λ = 565 nm i platta plattor med platt botten med 96 brunnar mot ett ämne som innehåller formamid. Färgen är stabil i 24 timmar. Läs av testprovernas koncentration från standardkurvan (använd koncentrationerna av Evans blue från 0,2–30 μg färgämne/ml formamid) (figur 8).
OBS: Plattorna måste vara gjorda av polypropen, som har en lägre bindningskapacitet så att proteiner eller DNA inte binder.
7. Serumuppsamling och anti-TNP-immunglobulin (IgG1) antikroppsmätning
- Efter insamling av öronbiopsier (steg 4.1), när musen fortfarande är under djupbedövning, ta bort ögongloben med pincett, sätt försiktigt tryck på musen och samla blod från retro-orbital sinus i röret (injektionsflaska med gel för att erhålla serum, se materialtabell). En alternativ metod för att samla blod kan vara att punktera hjärtat med en spruta och samla upp blodet.
OBS: Blodet måste samlas in efter att öronen har tagits bort. Samma blödningsmetod måste användas i en hel studie på grund av potentiella skillnader i blodparametrar18. Efter denna procedur måste möss avlivas (t.ex. genom cervikal dislokation). - Invertera minst 6x, vänta 30 min tills blodet koagulerar och centrifugera sedan vid 1 300-2 000 x g i 10 minuter vid RT.
OBS: Protokollet kan pausas här. Provet är stabilt vid −20 °C i 6 månader. - Täck en platta med 96 brunnars platt botten med 50 μl bovint serumalbumin konjugerat med 2,4,6-trinitrofenyl (TNP-BSA) upplöst i DPBS vid en konsert på 10 μg/ml. Belägg sedan den andra plattan med enbart bovint serumalbumin (BSA) upplöst i DPBS (bakgrund) i en koncentration av 10 μg/ml. Inkubera över natten vid 4 °C.
OBS: Musserum innehåller antikroppar (Abs) mot BSA, så proverna måste testas på båda plattorna, och därefter måste en beräkning göras (OD TNP-BSA - OD BSA). - Tvätta plattorna med 300 μL DPBS innehållande 0,05% Tween 20. Upprepa 3x.
- Förbered analysutspädningsmedel (AD): DPBS innehållande 1% BSA. Blockera brunnarna med AD i 1 timme vid RT. Tvätta igen (steg 7.4).
- Förbered en intern standard (iSTD): sensibilisera mössen med TNCB (steg 3.1.1-3.1.3) och samla in och polla serumet från alla givare 10 dagar efter sensibilisering (steg 7.1 och steg 7.2).
- Lägg till 50 μl graderade koncentrationer av iSTD utspädd med AD för att göra standardkurvan (beskriven i tabell 3) till plattan. Lägg till 50 μl serumprover på plattan. Testa varje prov och standardkurva på båda plattorna (TNP-BSA och BSA-belagda). Inkubera i 2 timmar vid RT. Tvätta plattorna (steg 7.4).
- Tillsätt 50 μL biotinylerad antimus IgG1 monoklonal antikropp (mAb, se materialtabell) utspädd 1:250 med AD och inkubera i 1 timme vid RT. Tvätta igen (steg 7.4).
- Tillsätt 50 μl pepparrotsperoxidasstreptavidin (HRD streptavidin, se materialtabell) utspätt 1:2000 med AD och inkubera i 30 minuter vid RT i mörker. Tvätta plattan (steg 7.4).
- Tillsätt 50 μL TMB-substrat (se materialtabell) och inkubera i 30 minuter vid RT i mörker.
- Stoppa den enzymatiska reaktionen genom att tillsätta 25 μl 1 MH2S04; reaktionen är stabil i 30 min.
- Mät OD vid en våglängd av λ = 450 nm och en bakgrund av 570 nm (bakgrunden måste subtraheras från varje 450 nm mätning). När du presenterar resultaten, subtrahera BSA-mätningarna från TNP-BSA för prover och standardkurvan. Beräkna sedan enheten (U) antikroppar enligt standardkurvan (figur 9).
8. Adoptiv överföring av CHS-effektorcellerna
OBS: Denna procedur visas i figur 2.
- Donatorer (i förhållandet mellan en donator:1 mottagare): sensibilisera möss med TNCB på dag "0" (steg 3.1.1-3.1.3).
- På dag "4", bedöva mössdjupbedövningen (steg 3.2.2).
- Isolera med pincett axillära och inguinala lymfkörtlar (ALNs) och mjälte (SPLs). Slå ihop ALG I en injektionsflaska och SPL:erna i en annan.
OBS: Det finns en axillär lymfkörtel bakom bröstmuskeln i varje axilla. En inguinal lymfkörtel i höftregionen ligger bredvid tre blodkärl. Mjälten ligger på vänster sida av kroppen bakom tarmen och magen19. Arbeta med sterila verktyg i ett biosäkerhetsskåp för att upprätthålla sterila förhållanden. Efter denna procedur måste mössen avlivas (t.ex. genom cervikal dislokation). - Mosvävnad mellan de frostat ändarna av två mikroskopglas. För cellsuspensionen genom en cellsil med en porstorlek på 70 μm (se materialtabell).
- Tvätta cellerna med DPBS kompletterat med 1% fetalt bovint serum (FBS). Centrifugera vid 300 x g i 10 min vid 4 °C. Dekantera supernatanten och återsuspendera den återstående cellpelleten i 1-5,0 ml DPBS.
- Räkna de levande cellerna med hjälp av en hemocytometer20 med Trypan-blått och blanda 10 μL av cellsuspensionen med 90-990 μL (beroende på cellnummer) trypanblått. Ta hänsyn till utspädningen vid beräkning av cellnumret (10x-100x).
- Förbered en blandning av ALN och SPL (förhållande 1: 1): 8,0 x 106 upp till 7,0 x 107 / mus i 200 μL DPBS.
- Mottagare (naiva syngena möss): bedöva naiva mottagarmöss (steg 3.2.2) och injicera i.v. med en beredd blandning av CHS-effektorcellerna (steg 8.7). I kontrollgruppen av möss, injicera inte några celler.
- Mät örontjockleken före (0 h) och efter (24 h) utmaningen (steg 3.2.1-3.2.6) (figur 10).
- Dessutom utföra tester på isolerade CHS-effektorceller (t.ex. cellfenotypning eller mätning av producerade cytokiner av CHS-effektorcellerna med flödescytometri). Cellkulturer kan också etableras, och CHS-effektorcellernas förmåga att föröka sig i närvaro av antigenet eller mängden utsöndrade cytokiner i odlingssupnatanten kan bedömas21,22 (data presenteras inte).
OBS: Att utföra ytterligare tester kräver motsvarande fler celldonatorer.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
För CHS-induktion sensibiliserades djuren via hudmålning (buk) med 150 μL 5% TNCB eller bluff sensibiliserade med fordonet ensamt. På dag "4" inducerades öronsvullnadssvaren i båda öronen av kontaktmålning (utmaning) med 10 μL 0,4% TNCB hos båda mössen som tidigare kontaktats sensibiliserade med TNCB (testgrupp) och kontrollgruppen möss (bluffsensibiliserade). De presenterade uppgifterna visar att mössen sensibiliserade med TNCB och utmanade 4 dagar senare utvecklade signifikant ökad öronsvullnad jämfört med de bluffsensibiliserade som på liknande sätt utmanades (Figur 3, tabell 2, test vs. kontrollgrupp). Resultaten av öronsvullnad validerades fullständigt i ytterligare studier, vilket belyser att en ökning av öronödem bestämd med en mikrometer överensstämde med ökad öronvikt (figur 4), MPO-aktivitet (figur 5), IFN-γ koncentration i öronextrakten (figur 6), ökad förtjockning av den edematösa dermis i den histologiska undersökningen (figur 7) och öronkärlspermeabilitet (figur 8 ). En ökning av koncentrationen av TNP-specifika IgG1-antikroppar hittades också i serum hos testmössen jämfört med kontrolldjuren (figur 9).
Som ett exempel på T-cellsmedierat immunsvar kan CHS också överföras till naiva syngena mottagarmöss. Givare sensibiliserades av TNCB-applikation, och därefter administrerades CHS-effektorcellerna i.v. i de naiva mottagarmössen, som utmanades med hapten och testades för CHS 24 timmar senare (Figur 10). Djuren som fick CHS-effektorcellerna från donatorer som tidigare sensibiliserats med TNCB visade signifikant ökad öronsvullnad jämfört med djur som endast utmanades (fick inga celler).
CHS-reaktionen har en komplex mekanism och involverar olika celler. Antigenpresentation och T/B-cellaktivering förekommer i de perifera lymforganen (t.ex. ALN och SPL). Det bestämdes att CHS-effektorceller utarmade av CD4 + men inte CD8 + -celler före adoptiv cellöverföring resulterade i frånvaron av CHS-reaktionen hos mottagarmössen. Dessa celler visade sig vara positiva för IFN-γ (T-box transkriptionsfaktor TBX21, Tbet+) och IL-17A (retinsyrareceptorrelaterad orphan nuclear receptor gamma, RORγT+) (kompletterande figur 1).
De presenterade resultaten från de representativa experimenten utfördes på C57BL/6 och CBA/J han- och honmöss vid 8-12 veckors ålder. I enlighet med 3R-reglerna vid användning av djur23, särskilt minskning, visas resultaten av experiment på små grupper av djur i denna artikel. Data i diagrammen visas som medelvärde ± SEM. Statistisk signifikans sattes till p < 0,05. Graferna ritades med hjälp av Prism-programvaran (se Materialtabell).

Figur 1: Induktion av CHS. Sensibilisering, utmaning och öronmätning. Förkortningar: CHS = kontaktöverkänslighetsreaktion; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att se en större version av denna siffra.

Figur 2: Adoptiv överföring av CHS-effektorcellerna. Förkortningar: ALNs = axillära och inguinala lymfkörtlar; CHS = kontaktöverkänslighetsreaktion; i.v. = intravenöst; SPL = mjälte; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att se en större version av denna siffra.

Figur 3: Representativ utvärdering av CHS till TNCB genom mätning av öronsvullnad med en mikrometer. Möss var TNCB (testgrupp) eller bluff (kontrollgrupp) sensibiliserade och därefter utmanade. Tjockleken på öronen mättes före och efter utmaningen, och skillnader i öronsvullnad beräknades genom att subtrahera 0 h örontjocklek (μm) från 24 h örontjocklek (μm). Öronsvullnad uttrycktes som genomsnittlig ± SEM, ****p < 0,0001, n = 10 möss/grupp (data från tabell 2). Förkortningar: CHS = kontaktöverkänslighetsreaktion; SEM = medelvärdets standardfel; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att se en större version av denna siffra.

Figur 4: Representativ utvärdering av CHS genom mätning av öronvikt. Öronvikt är en av parametrarna som motsvarar öronsvullnad. Möss var TNCB (testgrupp) eller bluff (kontrollgrupp) sensibiliserade och därefter utmanade. Vid 24 timmar efter utmaningen togs stansar med en diameter på 6 mm från de borttagna öronen. Stansarna vägdes på en analytisk laboratoriebalans. Öronvikten uttrycktes i milligram (mg) som medelvärde ± SEM, ***p < 0,001, n = 10 möss/grupp. Förkortningar: CHS = kontaktöverkänslighetsreaktion; SEM = medelvärdets standardfel; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att se en större version av denna siffra.

Figur 5: Representativ utvärdering av MPO-aktivitet. Ökad MPO-aktivitet i vävnadsextrakt korrelerar med öroninflammation. TNCB-sensibiliserade möss (testgrupp) och bluffsensibiliserade möss (kontrollgrupp) utmanades. Vid 24 timmar efter utmaningen avlägsnades öronen och 6 mm diameter stansar i örat extraherades och bearbetades. MPO-aktiviteten uttrycks i U per proteininnehåll (U/g protein). Resultaten visas som medelvärde ± SEM, **p < 0,01, n = 5-6 möss/ grupp. Förkortningar: CHS = kontaktöverkänslighetsreaktion; MPO = myeloperoxidas; SEM = medelvärdets standardfel; TNCB = 2,4,6-trinitroklorbensen; U = enheter. Klicka här för att se en större version av denna siffra.

Figur 6: Representativ utvärdering av cytokinproduktion-IFN-γ koncentration i öronextrakt. Möss var TNCB (testgrupp) eller bluff (kontrollgrupp) sensibiliserade och därefter utmanade. Vid 24 h efter utmaningen avlägsnades öronen och 6 mm diameter stansar i örat togs. Koncentrationen av IFN-γ bestämdes i vävnadshomogenater med ELISA. Resultaten visas som medelvärde ± SEM, *p < 0,05, n = 5 möss/grupp. Förkortningar: CHS = kontaktöverkänslighetsreaktion; IFN-γ = interferon gamma; SEM = medelvärdets standardfel; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att se en större version av denna siffra.

Figur 7: Representativ histologi av öronvävnaden. Hematoxylin och eosinfärgning. Möss var TNCB (testgrupp) eller bluff (kontrollgrupp) sensibiliserade och därefter utmanade. (A-C) Histologisk undersökning i testgruppen manifesterades i en signifikant ökad koncentration av inflammatoriska celler (mononukleära och polymorfonukleära celler), huvudsakligen i dermis, med mikroabscessbildning i epidermis. Förtjockning av edematös dermis och en förtjockad, hyperplastisk epidermis märktes också. (D-E) Kontrollgrupp. Klicka här för att se en större version av denna siffra.

Figur 8: Representativt test av vaskulär permeabilitet. Observerat öronvävnadsödem är ett resultat av ökad vaskulär permeabilitet. För att bestämma förändringar i vaskulär permeabilitet sensibiliserades möss TNCB (testgrupp) eller bluff (kontrollgrupp) och utmanades sedan 4 dagar senare. Vid 23 h efter utmaningen injicerades Evans blå, och 1 h efter Evans blå injektion avlivades djuren och 6 mm diameter stansar i örat gjordes. Resultaten visas som medelvärde ± SEM, **p < 0,01, n = 5 möss/grupp. Förkortningar: CHS = kontaktöverkänslighetsreaktion; SEM = medelvärdets standardfel; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att se en större version av denna siffra.

Figur 9: Representativ anti-TNP IgG1-antikroppsmätning. Koncentrationen av anti-TNP IgG1-antikroppar i serum mättes 24 timmar efter utmaningen med hapten TNCB hos bluffsensibiliserade (kontroll) och hos TNCB-sensibiliserade (testgrupp) möss. De insamlade serumen testades för antikroppskoncentration med ELISA. Resultaten visas som medelvärde ± SEM, ***p < 0,001, n = 10 möss/grupp. Förkortningar: CHS = kontaktöverkänslighetsreaktion; IgG1 = immunoglobulin G underklass 1; SEM = medelvärdets standardfel; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att se en större version av denna siffra.

Figur 10: Representativ adoptiv överföring av CHS-effektorcellerna. CHS-effektorcellerna erhölls från givare som sensibiliserades med TNCB. Därefter injicerades de insamlade immuncellerna, dvs. i naiva syngena mottagare, som utmanades för att framkalla CHS-effektorfasen. Kontrollgruppen av möss fick inga celler före utmaningen. Tjockleken på öronen mättes före och efter utmaningen. Resultaten visas som medelvärde ± SEM, ***p < 0,001, n = 7 möss/grupp. Förkortningar: CHS = kontaktöverkänslighetsreaktion; SEM = medelvärdets standardfel; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att se en större version av denna siffra.
| Mus belastning | Sensibiliseringslösning (dos) på rakad buk |
Eliciteringslösning (dos) på båda sidor av örat / s |
Sensibilisering / eliciteringsdag | Refs | |||||||||||
| Balb/c (H-2d). C57BL/6 (H-2b) TCRδ-/-, β2m-/-, CD1d-/- (B10 PL (H-2u bakgrund) |
25 μl 0,5 % DNFB i aceton-olivoljeblandning (förhållande 4:1) | 5 μl 0,1 % DNFB i aceton-olivoljeblandning (förhållande 4:1) | 0 / 5 | 22 | |||||||||||
| C57BL/6 (H-2b) | 50 μl 0,5 % DNFB i aceton-olivoljeblandning (förhållande 4:1) | 25 μl 0,2 % DNFB i aceton-olivoljeblandning (förhållande 4:1) | 0 / 5 | 32 | |||||||||||
| C57BL/6 (H2b). IL-17A-/- (C57BL/6 bakgrund) | 150 μl 5% TNCB i aceton-etanolblandning (förhållande 1:3) | 10 μl 0,4 % TNCB i blandning av olivolja och aceton (förhållande 1:1) | 0 / 4 | 33 | |||||||||||
| Cba/J (H-2k); C57BL/6 (H-2b) TLR2-/-, MyD88-/-, IL-17A-/- (C57BL/6 bakgrund) |
150 μl 5 % TNP-Cl (TNCB) i en aceton-etanolblandning (förhållande 1:3) | 10 μl 0,4 % TNP-Cl (TNCB) i blandning av olivolja och aceton (förhållande 1:1) | 0 / 4 | 21 | |||||||||||
| C57BL/6 (H-2b); Balb/c (H-2d) | 25 μl 1 % TNCB i en aceton | 10 μl 0,1 eller 0,2 % TNCB i en aceton (och högre upp till 1 %) | 0 / 7 | 34 | |||||||||||
| C57BL/6 (H-2b); TLR2-/-/ TLR4-/- (dubbel-knockout möss på C57BL / 6 bakgrund) |
100 μl 3 % TNCB i aceton | 20 μl 1 % TNCB i aceton (bara på baksidan av öronen) | 0 / 5 | 31 | |||||||||||
| C57BL/6 (H-2b) MHC klass II-bristfälliga möss (C57BL/6 bakgrund) |
100 μl 3 % TNCB i blandning av aceton och olivolja (förhållande 4:1) | 20 μl 0,5 eller 1 % TNCB i aceton-olivoljeblandning (förhållande 4:1) | 0 / 6 | 35 | |||||||||||
| C57BL/6 (H-2b) | 100 μl 7 % TNCB i en aceton | 20 μl 1 % TNCB i en aceton | 0 / 5 | 36 | |||||||||||
| C57BL/6 (H-2b) | 100 μl 3 % OX i etanol | 20 μl 1 % OX i en etanol | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/6 bakgrund) | 25 μl 0,5 % DNFB i aceton-olivolja (förhållande 4:1) | 10 μl 0,2 % DNFB i aceton-olivolja (förhållande 4:1) | 0 / 5 | 10 | |||||||||||
| C57BL/6 (H-2b); CD4-/-, CD8-/- (C57BL/6 bakgrund) | 150 μl 3 % OX i alkohol-aceton (förhållande 3:1) | 10 μl 1% OX i alkohol-aceton (förhållande 3:1) | 0 / 5 | ||||||||||||
| C57BL/6 (H-2b); C3H/HeN (H-2k); TLR4-/- (C3H/HeJ-bakgrund); MyD88-/- (C57BL/6 bakgrund) | 100 mg/öra av 10 % NiCl2 i vitt petrolatum på ryggsidan av båda öronen | 10 % NiCl2 i vit petrolatum | 0,1,2 / 23, 24 | 37 | |||||||||||
| NOD (H-2g7) MyD88-/- (NOD-bakgrund) | 400 μl 0,5 % FITC i aceton och dibutylftalat | 10 μl 0,1 % FITC i aceton och dibutylftalat | 0 / 5 | 25 | |||||||||||
Tabell 1: Jämförelse av CHS-modellen i olika studier. Förkortningar: DNFB = 1-fluor-2,4-dinitrobensen; FITC = fluoresceinitiocyanat; NiCl2 = nickel (II)klorid; TNCB = 2,4,6-trinitroklorbensen; TNP-Cl = trinitrofenylklorid; OX = oxazolon. Klicka här för att ladda ner denna tabell.
| Kontrollgrupp (negativ) | Testgrupp (CHS-reaktion) | ||||||
| Mus # öra: L, R | 0 h örontjocklek [μm] | 24 h örontjocklek [μm] | 24 h – 0 h örontjocklek [μm] | Mus # öra: L, R | 0 h örontjocklek [μm] | 24 h örontjocklek [μm] | 24 h – 0 h örontjocklek [μm] |
| 1 L | 365 | 380 | 15 | 1 L | 345 | 427.5 | 82.5 |
| 1 R | 335 | 380 | 45 | 1 R | 340 | 455 | 115 |
| 2 L | 345 | 355 | 10 | 2 L | 355 | 475 | 120 |
| 2 R | 327.5 | 352.5 | 25 | 2 R | 342.5 | 457.5 | 115 |
| 3 L | 340 | 370 | 30 | 3 L | 340 | 460 | 120 |
| 3 R | 325 | 355 | 30 | 3 R | 345 | 495 | 150 |
| 4 L | 335 | 380 | 45 | 4 L | 357.5 | 432.5 | 75 |
| 4 R | 340 | 350 | 10 | 4 R | 335 | 402.5 | 67.5 |
| 5 L | 350 | 380 | 30 | 5 L | 335 | 387.5 | 52.5 |
| 5 R | 337.5 | 360 | 22.5 | 5 R | 335 | 425 | 90 |
| 6 L | 335 | 365 | 30 | 6 L | 350 | 430 | 80 |
| 6 R | 340 | 375 | 35 | 6 R | 342.5 | 405 | 62.5 |
| 7 L | 345 | 337.5 | 0 | 7 L | 340 | 502.5 | 162.5 |
| 7 R | 345 | 335 | 0 | 7 R | 327.5 | 447.5 | 120 |
| 8 L | 370 | 380 | 10 | 8 L | 327.5 | 515 | 187.5 |
| 8 R | 375 | 355 | 0 | 8 R | 327.5 | 540 | 212.5 |
| 9 L | 385 | 370 | 0 | 9 L | 330 | 415 | 85 |
| 9 R | 342.5 | 362.5 | 20 | 9 R | 327.5 | 390 | 62.5 |
| 10 L | 307.5 | 340 | 32.5 | 10 L | 337.5 | 445 | 107.5 |
| 10 R | 325 | 350 | 25 | 10 R | 352.5 | 455 | 102.5 |
| Betyda | 20.75 | Betyda | 108.5 | ||||
| ± SEM | 3.245 | ± SEM | 9.565 | ||||
Tabell 2: Representativt exempel på beräkning av skillnaden i örontjocklek i effektorfasen för CHS. Beräkning av skillnaden i tjockleken på öronen före och efter utmaningen med hapten: 24 h örontjocklek (μm) - 0 h örontjocklek (μm). Varje öra räknas som ett separat mått. Öronsvullnad uttryckt i mikrometer (μm) ± SEM, n = 20. Förkortningar: L = vänster; R = rätt. Klicka här för att ladda ner denna tabell.
| iSTD-utspädning med AD | anti-TNP IgG1 Ab (U/ml) |
| 100x | 250 |
| 200 gånger | 125 |
| 400 gånger | 62.5 |
| 800 gånger | 31.25 |
| 1600x | 15.63 |
| 3200x | 7.8 |
| endast AD | 0 |
Tabell 3: Beredning av de olika koncentrationerna av iSTD för standardkurvan för mätning av anti-TNP IgG1 Ab. 100x iSTD-utspädningen antogs vara 250 U av anti-TNP IgG1 Ab. Förkortningar: Ab = antikropp; AD = analysutspädningsmedel; iSTD = intern standard; IgG1 = immunoglobulin G underklass 1; TNP = 2,4,6-trinitrofenyl; U = enheter. Klicka här för att ladda ner denna tabell.
Kompletterande figur 1: Fenotypen för CHS-effektorceller. CHS-effektorcellerna erhölls från donatorernas ALN och SPL, som tidigare sensibiliserades med TNCB. (A) Med hjälp av MACS-tekniken tömdes CHS-effektorcellerna (hela ALN och SPL) på antingen CD4 + eller CD8 + -celler. Därefter genomfördes adoptiv cellöverföring före elicitering av CHS-effektorfasen. (B-E) Med hjälp ± av en flödescytometriteknik färgades CHS-effektorn och naiva (erhållna från naiva möss) celler för IFN-γ, Tbet, IL-17A och RORγt före analys. Celler var gated för TCRβ + CD4 + -populationen. Resultaten visas som medelvärde ± SEM, ***p < 0,001, **p < 0,01, * p < 0,05, n = 4-6 möss/grupp. Förkortningar: ALNs = axillära och inguinala lymfkörtlar; CD4 = kluster av differentiering 4; CHS = kontaktöverkänslighetsreaktion; IFN-γ = interferon gamma; IL = interleukin; MACS = magnetaktiverad cellsortering; ns = icke signifikant; RORγt = retinsyra-syra-receptor-relaterad föräldralös kärnreceptor gamma; SEM = medelvärdets standardfel; SPL = mjälte; Tbet = T-box transkriptionsfaktor TBX21; TCRβ = T-cellreceptor beta; TNCB = 2,4,6-trinitroklorbensen. Klicka här för att ladda ner den här filen.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
CHS induceras via haptens, som binder till självproteinantigener i huden, vilket skapar neoantigens. CHS förmedlas av lokal extravaskulär rekrytering av cirkulerande antigenspecifika CHS-effektor T-celler, vilket resulterar i svullnad i den utmanade vävnaden, som toppar 24 timmar efter exponering av sekundärhuden för samma hapten6. Svullnaden i vävnaden orsakas huvudsakligen av infiltration av leukocyter och leukocytberoende fibrinavsättning24. Dessa förändringar kan detekteras med en mikrometer som mäter öronsvullnaden hos hapten-sensibiliserade och utmanade kontra bluff-sensibiliserade och utmanade möss.
CHS kan också bestämmas genom jämförelse av öronvikt. Sedan kan öronstansarna som används för bestämning av öronvikt användas för ytterligare tester. Cellen infiltrerar i de inflammerade öronen består av cytokinproducerande T-lymfocyter och MPO-positiva neutrofiler. I öronvävnadshomogenaten kan olika parametrar mätas, såsom MPO-aktivitet eller koncentrationen av proinflammatoriska cytokiner (t.ex. TNF-α, IFN-γ, IL-17A eller andra) med hjälp av ELISA-testet eller uttrycket av cytokin-mRNA i huden med qPCR-testet25. Dessutom kan förändringar i kärlpermeabiliteten utvärderas med hjälp av Evans blå test21,26.
I den inflammerade öronvävnaden kan de observerade förändringarna också kompletteras med in vitro-tester, vilket belyser T-cellproliferation och cytokinproduktion. Detta kan lätt åstadkommas genom odling av ALN i närvaro av haptenkonjugerade proteinantigener22,27. Utvärderingen av cytokinsekretion av ALNs isolerade från sensibiliserade men inte utmanade möss ger detaljer om cytokinproduktion av CHS-effektorcellerna i stället för deras induktion.
Begränsningar
Många mikrometer mäter öronsvullnad med olika noggrannhet. Till exempel utövas det lägsta trycket av en fjäderkaliper, så det verkar som om resultaten bäst återspeglar den faktiska tjockleksmätningen. Mikrometrar som utövar mer tryck, såsom Mitutoyo, kommer emellertid sannolikt att komprimera vätskan som ackumuleras i öronen i den tidiga fasen av ödembildning. Chs bifasiska natur kan visualiseras tydligare med hjälp av sådana mikrometrar eftersom mer tryck utövas. Detta är svårare när du använder en fjäderkaliper med lätt tryck28. Men i vissa studier mättes öronens tjocklek med en bromsok29. Observatörens erfarenhet säkerställer också noggranna mätningar, som kan påverkas av subjektiva känslor, även om observatören inte är medveten om experimentgrupperna.
Alternativa metoder har beskrivits här som kan hjälpa till att bekräfta mätningarna av öronsvullnad med en mikrometer, vilket gör de presenterade uppgifterna mer tillförlitliga och mindre subjektiva. Dessa alternativa strategier för att bedöma CHS kan dock endast användas vid en tidpunkt. Mikrometermätningar kan upprepas vid olika tidpunkter, vilket gör det möjligt att studera CHS-kinetiken.
Ändringar
Protokollet för att studera CHS-reaktionen vi använder i vårt laboratorium skiljer sig avsevärt från de som används i andra laboratorier, inklusive dosen av hapten och lösningsmedelskompositionen som används för både elicitering och sensibilisering, liksom den tidpunkt då reaktionen bedöms. Örontjockleken kan mätas vid olika tidpunkter (t.ex. 2 h, 24 h, 48 h och 72 h efter utmaningen)10,30. Tabell 1 visar olika experimentella modeller, särskilt skillnaderna i djurstammen, hapten och sensibiliserings-/utmaningstiderna som används i olika studier 10,21,22,26,31,32,33,34,35,36,37 . CHS-protokollet kan också utföras utan föregående rakning av mössens buk.
Nästa skillnad gäller utförandet av själva elicitationen (utmaningen). Som vanligt görs sensibiliseringen genom att måla rakade möss bukhud med hapten eller fordonet ensamt. Därefter utmanas i båda grupperna ett öra med utspädd hapten på varje öronsida. Som en kontroll är det motsatta örat målat med en identisk mängd fordon ensam10,31.
Kritiska steg
Det mest kritiska ögonblicket är att utlösa CHS, eftersom testresultaten beror på det. (1) Haptenlösning är mycket flyktig och ljuskänslig, så den måste vara tätt stängd och skyddad från ljus, och när den används måste den snabbt appliceras på djurens hud så att den inte avdunstar. (2) Efter applicering av hapten på bukets hud måste den torkas innan djuret återvänder till buret eftersom möss kan smeta det mot sängkläderna eller applicera det på öronen med sina tassar (då kan mätningen av tjockleken på öronen vara otillräcklig). (3) Olika metoder för märkning av djur, såsom märkning av mussvansar med en lösningsmedelsbeständig markör, är också kända. Färgämnena som finns i markören kan dock (inte studeras) bli en hapten och utlösa CHS. Därför valdes i denna studie en märkningsmetod som inte påverkar reaktionen. (4) Att välja en rakningsmetod är mycket viktigt eftersom det kan irritera huden. I detta protokoll användes en grå tvål eftersom den har lugnande egenskaper; det påskyndar behandlingen av mindre nedskärningar och festering sår, vilket hjälps av dess antibakteriella effekter. Det lugnar svullnad och inflammation i huden.
Ytterligare undersökningar och standardisering av de experimentella förfarandena, inklusive djuranvändning (stam och kön), krävs för att jämföra resultaten från olika studier.
Många olika miljöfaktorer och nya ämnen med biologiska funktioner kan testas i CHS-modellen. Denna modell kan vara användbar om forskare vill visa om testade faktorer modulerar T-cellberoende immunsvar.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har inget att avslöja.
Acknowledgments
Denna studie stöddes av subvention SUBZ. A020.22.060 från Medical University i Wroclaw, Polen, och genom bidrag från ministeriet för vetenskap och högre utbildning N N401 545940 till MS och IP2012 0443 72 till MMS.
Materials
| Name | Company | Catalog Number | Comments |
| 70% ethanol | Merck KGaA, Darmstadt, Germany | 65350-M | for surface disinfection |
| 96-well flat-bottom plates, polypropylene | Greiner Bio-One GmbH, Kremsmunster, Austria | 655101 | for MPO and Evans blue measurement - plates should be made of polypropylene, that has a lower binding capacity so proteins or DNA will not bind |
| Acetone (ACS reagent, ≥99.5%) | Merck KGaA, Darmstadt, Germany | 179124 | |
| Aluminum foil | Merck KGaA, Darmstadt, Germany | Z185140 | |
| Analytical balance | Sartorius Weighing Technology GmbH, Goettingen, Germany | PRACTUM224-1s, 29105177 | |
| Automated tissue processor | MediMeas Instruments, Sarsehri, Haryana, India | MTP-E-212 | automatically prepare tissue samples by fixing, dehydrating, clearing, and infiltrating them with paraffin |
| BD Vacutainer SST II Advance (tube with gel for obtaining serum) | Becton Dickinson (BD), Franklin Lakes, NJ, USA | BD 366882 | |
| Bicinchoninic acid kit for protein determination | Merck KGaA, Darmstadt, Germany | BCA1-1KT | |
| Biotin Rat Anti-Mouse IgG1 | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 553441 | |
| BSA (bovine serum albumine) | Merck KGaA, Darmstadt, Germany | A9418 | protein assays & analysis, 2 mg/mL |
| Cell strainer, pore size 70 μm | BIOLOGIX, China | 15-1070 | suitable for 50 mL tubes |
| Coverslip | VWR, Radnor, Pennsylvania, United States | 631-1583 | 24 mm, but it possible to use different size |
| Disposable pipettes capacity: 5 mL, 10 mL, 25 mL | Merck KGaA, Darmstadt, Germany | Z740301, Z740302, Z740303 | |
| DPBS (Dulbecco′s phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 14190144 | no calcium, no magnesium, mammalian cell culture |
| DPX Mountant for histology | Merck KGaA, Darmstadt, Germany | 6522 | mounting media for H-E, might be used some other e.g, Canada balsam |
| Dumont 5 tweezers - straight | Animalab, Poznan, Poland | 11251-10FST | surgical instruments for procedures on mice (should be steriled) |
| Dumont 7 tweezers - bent | Animalab, Poznan, Poland | 11272-50FST | surgical instruments for procedures on mice (should be steriled) |
| Eosin Y solution, alcoholic | Merck KGaA, Darmstadt, Germany | HT110116 | |
| Eppendorf Safe-Lock Tubes 1.5 mL | Eppenforf, Germany | 3,01,20,086 | polypropylene |
| Eppendorf Safe-Lock Tubes, 2.0 mL | Eppenforf, Germany | 3,01,20,094 | polypropylene, round bottom (the homogenization beads can easily move) |
| Ethanol 100% (absolute alkohol) | Merck KGaA, Darmstadt, Germany | 1.07017 | |
| Ethanol 96% | Merck KGaA, Darmstadt, Germany | 1.59010 | |
| Evans blue | Merck KGaA, Darmstadt, Germany | E2129 | |
| FBS (fetal bovine serum) | ThermoFisher Scientific, Waltham, Massachusetts, USA | A3160802 | |
| Formalin solution, neutral buffered, 10% | Merck KGaA, Darmstadt, Germany | HT501128 | |
| Formamide 99.5% (GC) | Merck KGaA, Darmstadt, Germany | F7503 | |
| Freezer -20 °C | Bosch, Germany | GSN54AW30 | |
| Fridge +4 °C / freezer -20 °C | Bosch, Germany | KGV36V10 | mammalian Cell Culture, qualified, Brazil, 10 x 50 mL |
| Glass microskope slides, SuperFrost Plus | VWR, Radnor, Pennsylvania, United States | 631-0108, 631-0446, 631-0447, 631-0448, 631-0449 | Slides that eliminates the need to apply adhesive materials or protein coatings, to preventing any tissue sections loss during staining. |
| Graph Pad Prism | GraphPad Software Inc. | v. 9.4.0 | |
| Grey soap | Pollena Ostrzeszów, Producent Chemii Gospodarczej Sp. Z.o.o. , Sp. K., Poland | Bialy jelen soap bar | grey Soap Bar Natural Hypoallergenic. Generally available product |
| H2SO4 (sulfuric acid) 1 mol/l (1 M) | Merck KGaA, Darmstadt, Germany | 1.60313 | |
| Harris hematoxylin solution | Merck KGaA, Darmstadt, Germany | HHS16 | |
| Hemocytometer | VWR, Avantor, U.S.A | 612-5719 | manual counting chamber is recommend, which is more accurate |
| Hexadecyltrimethylammonium bromide | Merck KGaA, Darmstadt, Germany | H5882 | |
| Homogenizer | QIAGEN Hilden, Germany | Tissue Lyser LT, SN 23.1001/05234 | homogenizer with stainless steel beads (diameter 5 mm) for 2 mL centrifuge tubes |
| Horseradish peroxidase streptavidin (HRP streptavidin) | Vector Laboratories, Inc., Burlingame, CA, USA | SA-5004-1 | |
| Hydrogen peroxide solution (H202) | Merck KGaA, Darmstadt, Germany | H1009 | |
| Incubator Heracell 150i | Thermo Electron LED Gmbh, Germany | 41071068 | 37 oC in the atmosphere of 5 % CO2, and 65 0C for deparaffinization the sections for histology |
| Ketamine 100 mg/mL, solution for injection | Biowet Pulawy Sp. z o.o., Pulawy, Poland | cat.# not avaliable | |
| KH2PO4 (potassium dihydrogen phosphate) 99.995% anhydrous basis | Merck KGaA, Darmstadt, Germany | 1.05108 | |
| Laboratory Centrifuge | Heraeus Megafuge 1.0R, Thermo Scientific, Germany | B00013899 | speed to 300 x g, with cooling to 4 0C |
| Laboratory Centrifuge | Heraeus Fresco 21, Thermo Scientific, Germany | 75002425 | speed to 3,000 x g, with cooling to 4 0C |
| Mask (FFP2) | VWR, Radnor, Pennsylvania, United States | 111-0917 | for working with ortho-dianisine dihydrochloride |
| Mice | Breeding unit of the Chair of Biomedical Sciences, Faculty of Health Sciences, Jagiellonian University Medical College, Krakow, Poland | CBA/J, C57BL/6 | |
| Micrometer | Mitutoyo, Tokyo, Japan | 193-111 | digit Outside Micrometer, Ratchet Stop, 0-25mm Range, 0.001mm Graduation, +/-0.002mm Accuracy, https://shop.mitutoyo.pl/web/mitutoyo/pl_PL/all/all/Mikrometr%20analogowy%20/PR/193-111/index.xhtml |
| microplate, 96 well, microlon, high binding (for ELISA test) | Greiner Bio-One GmbH, Kremsmunster, Austria | 655061 | with maxi-sorp binding surfaces for reliable and reproducible results in colormetric assays |
| Microscope with objectives | Leica Microsystems CMS GmbH, Germany | DM1000, 294011-082007 | histology presented in the paper was performed under ThermoFisher Scientific EVOS M5000 Imaging System, with objectives: FL 20X LWDPH, 0.40NA/3.1WD and FL 40X LWDPH 0.65NA/1.79WD |
| Myeloperoxidase from human leukocytes (MPO standard) | Merck KGaA, Darmstadt, Germany | M6908 | |
| Na2HPO4 x 7 H2O (sodium phosphate dibasic heptahydrate) | Merck KGaA, Darmstadt, Germany | S9390 | |
| Olive-oil | Merck KGaA, Darmstadt, Germany | 75343 | pure, natural |
| OptEIA Mouse IFN-γ ELISA Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555138 | |
| Ortho-dianisine dihydrochloride | Merck KGaA, Darmstadt, Germany | D3252 | |
| Paraffin wax | Merck KGaA, Darmstadt, Germany | 76242 | beads, waxy solid |
| PBS (phosphate buffered saline) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 20012027 | pH 7.2, mammalian cell culture |
| ph meter | Elmetron, Poland | CP-401 | |
| Pipettes, variable volume with tips | Merck KGaA, Darmstadt, Germany | EP3123000900-1EA | 3-pack, Option 1, 0.5-10 uL/10-100 uL/100-1000 uL, includes epT.I.P.S. |
| Razor blade | VWR, Radnor, Pennsylvania, United States | PERS94-0462 | scraper and cutter blades, single edge, aluminium spine, 100 blades per box, individually wrapped |
| Rotary microtome | MRC Laboratory-Instruments, Essex, CM20 2HU UK | HIS-202A | |
| Scissors - straight, sharp / sharp | Animalab, Poznan, Poland | 14060-10FST | Surgical instruments for procedures on mice (should be steriled) |
| Screw cap (open top) | Merck KGaA, Darmstadt, Germany | 27056 | black polypropylene hole cap, for use with 22 mL vial with 20-400 thread |
| Spectrophotometer | BioTek Instruments, U.S.A | 201446 | universal microplate spectrophotometer: λ range: 200 - 999 nm, absorbance measurement range: 0.000 - 4.000 Abs |
| Staining dish 20 slides with rack | Merck KGaA, Darmstadt, Germany | S6141 | e.g. 20 slide staining dishes complete with covers, slide rack and handle |
| Sterile Disposable Biopsy Punch 6mm | Integra LifeSciences, Princeton, NJ, USA | 33-36 | |
| Surgical scissors | Animalab, Poznan, Poland | 52138-46 | surgical instruments for procedures on mice (should be steriled) |
| Tissue processing cassettes | Merck KGaA, Darmstadt, Germany | Z672122 | tissue processing/ embedding cassettes with lid |
| TMB Substrate Reagent Set | Becton Dickinson (BD Biosciences), Franklin Lakes, NJ, USA | 555214 | |
| TNCB (2,4,6-trinitrochlorobenzene) | Tokyo Chemical Industry CO., LTD, Japan | C0307 | |
| TNP-BSA (bovine serum albumin conjugated with 2,4,6-trinitrophenyl) | Biosearch Technologies LGC, Petaluma, CA, USA | T-5050 | |
| T-PER (tissue protein extration reagent) | ThermoFisher Scientific, Waltham, Massachusetts, USA | 78510 | |
| Tubes 15 mL sterile | Merck KGaA, Darmstadt, Germany | CLS430055 (Corning) | polypropylene, conical bottom |
| Tubes 50 mL, sterile | Merck KGaA, Darmstadt, Germany | CLS430290 (Corning) | polypropylene, conical bottom |
| Tween 20 | Merck KGaA, Darmstadt, Germany | P1379 | |
| Vials, screw top, clear glass (vial only) 22 mL | Merck KGaA, Darmstadt, Germany | 27173 | for the preparation of hapten, screwed on so that it does not evaporate |
| Water bath | AJL Electronic, Poland | LW102 | |
| Wax (paraffin) dispenser | VWR, Radnor, Pennsylvania, United States | 114-8737 | |
| Xylazine (xylapan 20 mg/mL) solution for injection | Vetoquinol Biowet Sp. z o.o., Gorzow Wielkopolski, Poland | cat.# not avaliable | |
| Xylene (histological grade) | Merck KGaA, Darmstadt, Germany | 534056 |
References
- Nosbaum, A., Vocanson, M., Rozieres, A., Hennino, A., Nicolas, J. F. Allergic and irritant contact dermatitis. European Journal of Dermatology. 19 (4), 325-332 (2009).
- Hertl, M., et al. Predominance of epidermal CD8+ T lymphocytes in bullous cutaneous reactions caused by beta-lactam antibiotics. The Journal of Investigative Dermatology. 101 (6), 794-799 (1993).
- Martin, S. F. T lymphocyte-mediated immune responses to chemical haptens and metal ions: implications for allergic and autoimmune disease. International Archives of Allergy and Immunology. 134 (3), 186-198 (2004).
- Takeyoshi, M., Iida, K., Suzuki, K., Yamazaki, S. Skin sensitization potency of isoeugenol and its dimers evaluated by a non-radioisotopic modification of the local lymph node assay and guinea pig maximization test. Journal of Applied Toxicology. 28 (4), 530-534 (2008).
- Nakamura, K., Aizawa, M. Studies on the genetic control of picryl chloride contact hypersensitivity reaction in inbred rats. Transplantation Proceedings. 13 (2), 1400-1403 (1981).
- Asherson, G. L., Ptak, W. Contact and delayed hypersensitivity in the mouse. I. Active sensitization and passive transfer. Immunology. 15 (3), 405-416 (1968).
- Honda, T., Egawa, G., Grabbe, S., Kabashima, K. Update of immune events in the murine contact hypersensitivity model: toward the understanding of allergic contact dermatitis. The Journal of Investigative Dermatology. 133 (2), 303-315 (2013).
- Kaplan, D. H., Jenison, M. C., Saeland, S., Shlomchik, W. D., Shlomchik, M. J. Epidermal langerhans cell-deficient mice develop enhanced contact hypersensitivity. Immunity. 23 (6), 611-620 (2005).
- Wang, L., et al. Langerin expressing cells promote skin immune responses under defined conditions. Journal of Immunology. 180 (7), 4722-4727 (2008).
- Wang, B., et al. CD4+ Th1 and CD8+ type 1 cytotoxic T cells both play a crucial role in the full development of contact hypersensitivity. Journal of Immunology. 165 (12), 6783-6790 (2000).
- Mori, T., et al. Cutaneous hypersensitivities to hapten are controlled by IFN-gamma-upregulated keratinocyte Th1 chemokines and IFN-gamma-downregulated langerhans cell Th2 chemokines. The Journal of Investigative Dermatology. 128 (7), 1719-1727 (2008).
- Peszkowski, M. J., Warfvinge, G., Larsson, A. Allergic and irritant contact responses to DNFB in BN and LEW rat strains with different TH1/TH2 profiles. Acta Dermato-Venereologica. 74 (5), 371-374 (1994).
- Henningsen, S. J., Mickell, J., Zachariae, H. Plasma kinins in dinitrochlorobenzene contact dermatitis of guinea-pigs. Acta Allergologica. 25 (5), 327-331 (1970).
- Maibach, H. I., Maguire, H. C. Elicitation of delayed hypersensitivity (DNCB contact dermatitis) in markedly panleukopenic guinea pigs. The Journal of Investigative Dermatology. 41, 123-127 (1963).
- Martel, B. C., Lovato, P., Bäumer, W., Olivry, T. Translational animal models of atopic dermatitis for preclinical studies. The Yale Journal of Biology and Medicine. 90 (3), 389-402 (2017).
- Jin, H., He, R., Oyoshi, M., Geha, R. S. Animal models of atopic dermatitis. The Journal of Investigative Dermatology. 129 (1), 31-40 (2009).
- Li, Y. Z., Lu, X. Y., Jiang, W., Li, L. F. Anti-inflammatory effect of qingpeng ointment in atopic dermatitis-like murine model. Evidence-Based Complementary and Alternative. 2013, 907016 (2013).
- Hoggatt, J., Hoggatt, A. F., Tate, T. A., Fortman, J., Pelus, L. M. Bleeding the laboratory mouse: Not all methods are equal. Experimental Hematology. 44 (2), 132-137 (2016).
- Bedoya, S. K., Wilson, T. D., Collins, E. L., Lau, K., Larkin, J. Isolation and th17 differentiation of naïve CD4 T lymphocytes. Journal of Visualized Experiments. (79), e50765 (2013).
- Vlab, A. Hemocytometer - Counting of Cells. Amrita University. , Available from: https://www.youtube.com/watch?v=MKS0KM3lr90 (2011).
- Majewska-Szczepanik, M., Strzepa, A., Marcińska, K., Wen, L., Szczepanik, M. Epicutaneous immunization with TNP-Ig and Zymosan induces TCRαβ+ CD4+ contrasuppressor cells that reverse skin-induced suppression via IL-17A. International Archives of Allergy and Immunology. 164 (2), 122-136 (2014).
- Majewska-Szczepanik, M., Zemelka-Wiącek, M., Ptak, W., Wen, L., Szczepanik, M. Epicutaneous immunization with DNP-BSA induces CD4+ CD25+ Treg cells that inhibit Tc1-mediated CS. Immunology and Cell Biology. 90 (8), 784-795 (2012).
- Directive 2010/63 / EU of the European Parliament and of the Council of 22 September 2010 on the protection of animals used for scientific purposes. Official Journal of the European Union. , Available from: https://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2010:276:0033:0079:En:PDF (2010).
- Colvin, R. B., Dvorak, H. F. Role of the clotting system in cell-mediated hypersensitivity. II. Kinetics of fibrinogen/fibrin accumulation and vascular permeability changes in tuberculin and cutaneous basophil hypersensitivity reactions. Journal of Immunology. 114, 377-387 (1975).
- Szczepanik, M., et al. Regulation of contact sensitivity in non-obese diabetic (NOD) mice by innate immunity. Contact Dermatitis. 79 (4), 197-207 (2018).
- Askenase, P. W., Majewska-Szczepanik, M., Kerfoot, S., Szczepanik, M. Participation of iNKT cells in the early and late components of Tc1-mediated DNFB contact sensitivity: Cooperative role of γδ-T cells. Scandinavian Journal of Immunology. 73 (5), 465-477 (2011).
- Zemelka-Wiącek, M., Majewska-Szczepanik, M., Ptak, W., Szczepanik, M. Epicutaneous immunization with protein antigen induces antigen-non-specific suppression of CD8 T cell mediated contact sensitivity. Pharmacological Reports. 64 (6), 1485-1496 (2012).
- Van Loveren, H., et al. Use of micrometers and calipers to measure various components of delayed-type hypersensitivity ear swelling reactions in mice. Journal of Immunological Methods. 67 (2), 311-319 (1984).
- Tsuji, R. F., et al. B cell-dependent T cell responses: IgM antibodies are required to elicit contact sensitivity. The Journal of Experimental Medicine. 196 (10), 1277-1290 (2002).
- Campos, R. A., et al. Cutaneous immunization rapidly activates liver invariant Valpha14 NKT cells stimulating B-1 B cells to initiate T cell recruitment for elicitation of contact sensitivity. The Journal of Experimental Medicine. 198 (12), 1785-1796 (2003).
- Rühl-Muth, A. C., Maler, M. D., Esser, P. R., Martin, S. F. Feeding of a fat-enriched diet causes the loss of resistance to contact hypersensitivity. Contact Dermatitis. 85 (4), 398-406 (2021).
- Bour, H., et al. histocompatibility complex class I-restricted CD8+ T cells and class II-restricted CD4+ T cells, respectively, mediate and regulate contact sensitivity to dinitrofluorobenzene. European Journal of Immunology. 25 (11), 3006-3010 (1995).
- Majewska-Szczepanik, M., et al. Obesity aggravates contact hypersensitivity reaction in mice. Contact Dermatitis. 87 (1), 28-39 (2022).
- Katagiri, K., Arakawa, S., Kurahashi, R., Hatano, Y. Impaired contact hypersensitivity in diet-induced obese mice. Journal of Dermatological Science. 46 (2), 117-126 (2007).
- Bouloc, A., Cavani, A., Katz, S. I. Contact hypersensitivity in MHC class II-deficient mice depends on CD8 T lymphocytes primed by immunostimulating Langerhans cells. The Journal of Investigative Dermatology. 111 (1), 44-49 (1998).
- Martin, S., et al. Peptide immunization indicates that CD8+ T cells are the dominant effector cells in trinitrophenyl-specific contact hypersensitivity. The Journal of Investigative Dermatology. 115 (2), 260-266 (2000).
- Vennegaard, M. T., et al. Epicutaneous exposure to nickel induces nickel allergy in mice via a MyD88-dependent and interleukin-1-dependent pathway. Contact Dermatitis. 71 (4), 224-232 (2014).
Tags
Immunologi och infektion utgåva 187 murinmodell allergisk kontaktdermatit (ACD) kontaktöverkänslighet (CHS) öronsvullnad vaskulär permeabilitet myeloperoxidas (MPO) cytokiner 2,4,6-trinitroklorbensen (TNCB) haptenErratum
Formal Correction: Erratum: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis
Posted by JoVE Editors on 01/19/2023.
Citeable Link.
An erratum was issued for: Contact Hypersensitivity as a Murine Model of Allergic Contact Dermatitis. The Protocol and Representative Results sections were updated.
Step 3.2.1 of the Protocol has been updated from:
On day "4", prepare 0.4% hapten: TNCB in an acetone-ethanol mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
to:
On day "4", prepare 0.4% hapten: TNCB in an acetone: olive oil mixture (ratio 1:1). Prepare the solution just before use in a glass vial and protect it from light by covering the vial with aluminum foil.
Figure 1 of the Representative Results has been updated from:
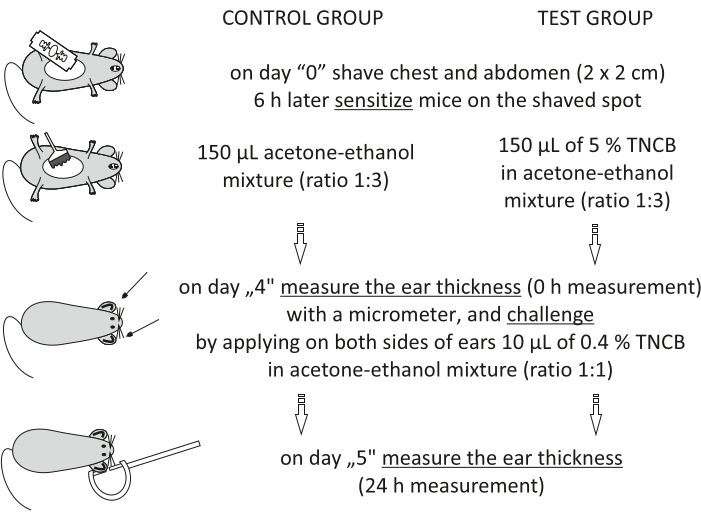
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
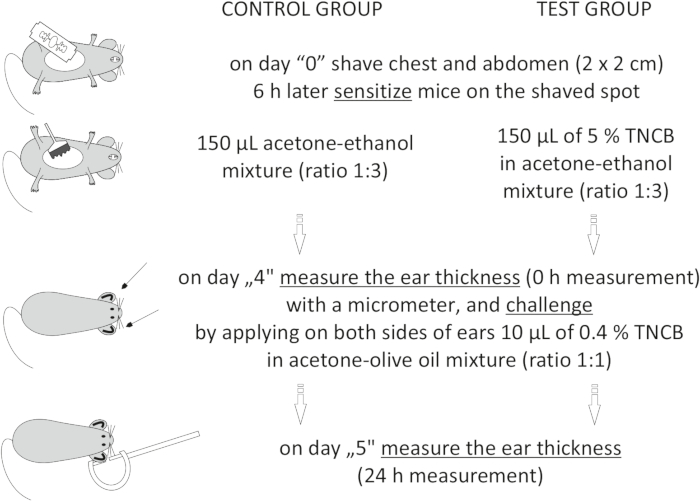
Figure 1: Induction of CHS. Sensitization, challenge, and ear measurement. Abbreviations: CHS = contact hypersensitivity reaction; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
Figure 2 of the Representative Results has been updated from:
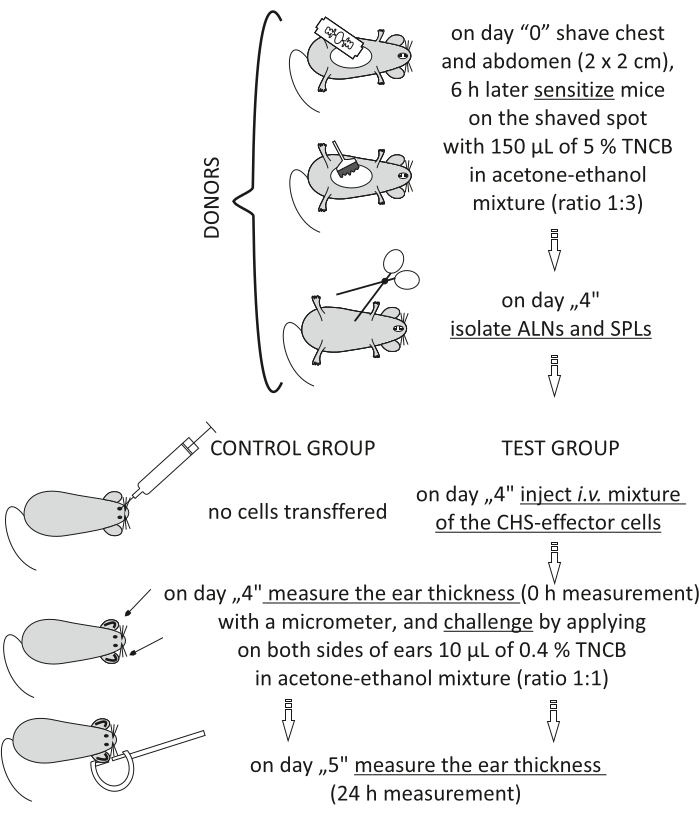
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.
to:
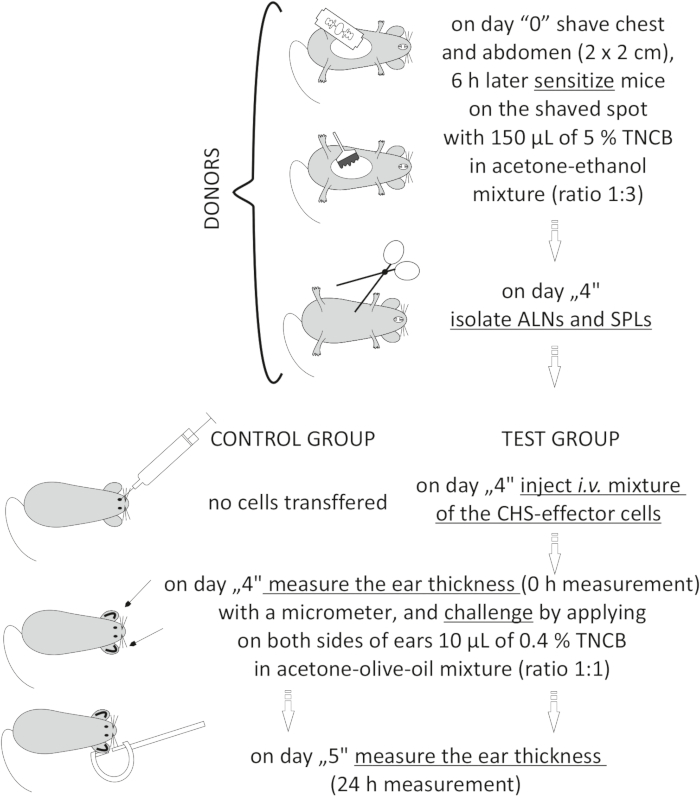
Figure 2: Adoptive transfer of the CHS-effector cells. Abbreviations: ALNs =axillary and inguinal lymph nodes; CHS = contact hypersensitivity reaction; i.v. = intravenously; SPLs = spleens; TNCB = 2,4,6-trinitrochlorobenzene. Please click here to view a larger version of this figure.



