Overview
Source : Laboratoire de Dr. Dana Lashley - College of William and Mary
Démonstration par : Matt Smith
Lorsque les nouvelles obligations sont formées au cours d’une réaction chimique, il faut que les espèces impliquées (atomes ou molécules) sont très proches et se heurtent dans l’autre. Les collisions entre ces espèces sont plus fréquente et plus efficace plus la vitesse à laquelle ces molécules sont déplacent. Une règle largement utilisée, qui a ses racines dans la Arrhenius équation1, stipule que l’élévation de la température de 10 K sera environ le double du taux de réaction, et élévation de la température de 20 K va quadrupler le taux :
(1)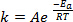
L’équation (1) se trouve souvent dans sa forme logarithmique :
(2)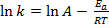
où k est la vitesse de la réaction chimique, A est le facteur de fréquence (relatif à la fréquence des collisions moléculaires), Eun est l’énergie d’activation nécessaire pour la réaction, R est la constante des gaz parfaits et T est la température à laquelle se déroule la réaction.
Une température plus élevée signifie donc qu'une réaction est effectue beaucoup plus rapidement. Néanmoins, dans certains cas, il est souhaitable de réaliser des réactions à basse température, en dépit de l’abaissement effet sur la vitesse de la réaction. Quelques scénarios sont à cet égard précisés plus loin.
Quand il est utile d’exécuter une réaction sous la température ambiante, chimistes utilisent bains de refroidissement pour maintenir une certaine température ou température ambiante. Les réactions sont refroidies à la température désirée en plaçant le ballon à réaction à l’intérieur d’un bain de refroidissement approprié. Les réactifs de la réaction jamais entrent en contact direct avec les produits chimiques dans le bain de refroidissement. Le bain de refroidissement peut consister en un seul composant cryogénique (refroidissement) (par exemple, glace, neige carbonique ou l’azote liquide) ou peut-être un mélange de la composante cryogénique avec un certain solvant et/ou un sel additif. Le but du solvant est de transférer efficacement la température de l’agent de refroidissement dans le ballon de réaction et l’additif vise à abaisser le point de congélation du mélange (ou bien appuyez sur). (Notez qu’il est possible pour une substance à la fois un solvant et additif).
Principles
Rappelons que lorsqu’une solution gèle à une température plus basse que le liquide pur, ceci est causé par une propriété colligative connue comme l’abaissement du point de congélation. L’effet de descente sur le point de congélation est proportionnelle à la quantité de soluté (additive) qui est ajoutée à un solvant liquide. Cet effet, est décrit par l’équation (3) :
(3) ΔDTf = Tf (solvant) − Tf (solution) = Kf × m
Δ DT f est l’abaissement du point de congélation et est décrit par la différence de température du solvant de congélation par elle-même et celle de la solution avec additif/soluté.
K f est la constante de la dépression du point de congélation pour le système, et m est la molalité de la solution. Chimistes permet de créer une diversité de différentes températures avec rapport coût-efficacité et de facilité cet effet à leur avantage.
La température obtenue par refroidissement des bains peut fluctuer. Le bain doit être surveillé et des modifications apportées au besoin. Pour de meilleurs résultats, le navire de bain lui-même devrait être bien isolé. Lorsqu’elle est disponible, une fiole de Dewar doit être utilisée pour le bain de refroidissement. En l’absence d’une fiole de Dewar, il est possible de mettre en place la baignoire dans un récipient en verre ou en caoutchouc, alors que le navire isolé autant que possible (utilisant par exemple le papier d’aluminium ou une serviette). Le navire utilisé doit être thermo-stable à la température désirée et ne se fendille pas.
Nombreuses variantes de bain différents existent pour la réalisation simple et relativement économique des différentes températures inférieures à la température ambiante dans un laboratoire chimique.
- Pour températures légèrement inférieures à zéro (mais si nécessaire jusqu'à - 55 ° C), un bain d’eau glacée additionnée de différents sels servira.
- Pour des températures jusqu'à-78 ° C, sèche-glace-bains dans différents solvants sont employés.
- Des températures inférieures à-78 ° C à-196 ° C peuvent être obtenus par l’utilisation de l’azote liquide.
Mise en place de ces bains de refroidissement est relativement simple et les procédures sont inclus à la fin du présent document.
Bains d’eau glacée
Ce type de baignoire est très facile à mettre en place et disponible dans chaque laboratoire d’enseignement de premier cycle. Il y a beaucoup de flexibilité dans le type de bateau de bain d’utiliser, parce que les bains de glace ne parviennent pas à des températures très basses et il n’y a aucun risque de fissuration d’un navire.
Alors que la glace-eau, lui-même a une température de 0 ° C, un abaissement du point de fusion est possible par l’ajout de certains sels tels que NaCl, MgCl2 ou CaCl2. Les températures finales atteints varient et peuvent être réglés par la quantité d’additif utilisé par 100 g de glace. Un bain de glace commun est un avec NaCl en tant qu’additif dans 33 g de NaCl sont ajoutés par 100 g de glace. La température finale obtenue par ce moyen est autour de-20 ° C. La température la plus froide que peut atteindre un bain d’eau glacée est autour de-55 ° C, qui est obtenue par l’addition de 143 g de CaCl2 hexahydraté pour 100 g de glace.
Sec-glace-bains
La glace sèche est du dioxyde de carbone solide et sublimes à une température de-78 ° C. C’est un agent cryogène assez peu coûteux et facilement disponible dans de nombreux laboratoires. Pour le transfert de chaleur efficace de cette température dans une cuve de réaction, il faut un solvant qui a un point de fusion inférieures à-78 ° C. Solvants avec un point de fusion plus élevé, ou un député, (mieux dénommé point de congélation en l’espèce) peuvent également être utilisés et donner lieu à une température plus élevée de la salle de bain.
Un solvant est souvent utilisé dans un bain de glace-sec-est l’acétone (mp =-95 ° C), qui est facilement disponible et peu coûteux. Un bain de glace sèche dans l’acétone maintient une température de-78 ° C pendant une période de temps, dont la longueur dépend du degré d’isolation. C’est le système le plus commun de sec-glace-bain.
Pour les température supérieures sec-glace-bains, solvants avec des points de congélation plus élevé sont utilisés. La température du bain acquis ne correspond pas toujours au point de congélation du solvant. Veuillez vous référer au tableau 2 pour les températures obtenues par différents systèmes.
En raison de la basse température atteinte par ce type de bain, gants de protection cryogénique doivent toujours être portées lors de la manipulation de glace sèche.
Le bateau de bain pour un bain de glace sèche est idéalement un Dewar. Si un Dewar n’est pas disponible, un bâtiment en verre, en caoutchouc ou en acier inoxydable est utilisé, mais sachez que l’isolation ne sera pas très optimale et la baignoire doit être ajustée plus souvent.
| Température de bain refroidissement cryogénique | |
| Mélange | T (° C) |
| p-xylène/carboglace | + 13 |
| Cyclohexane/carboglace | + 6 |
| Benzène/carboglace | + 5 |
| L’éthylène glycol/carboglace | -15 |
| Le tétrachlorure de carbone/carboglace | -23 |
| 3-Heptanone/carboglace | -38 |
| Acetonenitrile/glace | -42 |
| Cylcohexanone/glace | -46 |
| Diéthyl carbitol/carboglace | -52 |
| Chloroforme/Dry ice | -61 |
| Carbitol acétate/carboglace | -67 |
| Éthanol/carboglace | -72 |
| L’acétone/carboglace | -78 |
| Isopropanol/carboglace | -78 |
Le tableau 2. Liste des différents mélanges de glace sèche-salle d’eau.
Bains d’azote liquide
Bains de neige fondante d’azote liquide sont utilisés lors de températures très basses, inférieure à celle d’un sèche-glace-bain, sont souhaitées. L’azote liquide est un agent cryogène avec un point de fusion de-196 ° C, qui est la température du bain si aucun solvant supplémentaire n’est utilisé. Noter que, contrairement à la glace sèche, N2 est un liquide et l’utilisation d’un solvant additif pour le transfert de chaleur uniforme n’est pas nécessaire. Si vous souhaitez des températures supérieures à-196 ° C, une variété de différents solvants organiques est utilisée pour les mélanges qui donnera lieu à des températures différentes, semblables, comme ce fut le cas avec sèche-glace-bains. Veuillez vous référer au tableau 3 pour les températures obtenues par différents systèmes.
En raison de la très basse température des bains de liquide N2 , seulement un Dewar doit être utilisé comme le bateau de bain et toujours travailler avec des gants lorsque vous manipulez cet agent cryogénique.

Tableau 3. Liste d’azote liquide bains avec différents solvants. 2
Subscription Required. Please recommend JoVE to your librarian.
Procedure
Installation de salle de bain de refroidissement
Pour une configuration générale, préparer le bain de refroidissement de choix tel que décrit ci-dessous et plonger le ballon à réaction dans le bain (Figure 1). Ne remplissez pas le bateau de bain complètement, mais laisser assez d’espace pour permettre l’immersion du ballon à réaction.
Remarque : si la réaction est l’humidité sensible, soyez très prudent lors de l’ajout de réactifs à la fiole ou toute autre partie de l’appareil (par exemple un entonnoir). Si une ouverture est générée lorsque la verrerie est plongée dans le bain de refroidissement, puis température ambiante flux d’air rapidement à l’intérieur et transporte l’humidité en.

La figure 1. Exemple pour un set-up de bain refroidissement dans un ballon à fond rond trois-cou avec entonnoir à robinet, thermomètre sous atmosphère inerte.
1. faire un bain d’eau glacée
- Pour un bain d’eau glacée avec un additif, peser et ajouter la quantité appropriée de glace dans la cuve de bain de choix. Un Dewar est utile mais pas nécessaire. Le navire peut être en plastique, en caoutchouc (par exemple un seau), ou en verre (par exemple un plat de grande cristallisation). Pour cette expérience, ajouter 500 g de glace dans un récipient de 1 L.
- Peser la quantité appropriée d’additif consulting un bain de glace (tableau 1) et ajouter l’additif à la glace. Pour cette expérience, peser et ajouter 165 g (= 5 x 33 g) de NaCl dans la cuve de la baignoire.
- Ajouter une petite quantité d’eau déionisée dans la cuve de la baignoire et mélanger soigneusement avec une tige de remuer. Ajouter juste assez d’eau jusqu'à ce que toute la glace est couvert.
- Vérifiez avec un thermomètre pour s’assurer que la température désirée est atteinte. Ajuster la quantité d’additif si nécessaire. Le bain ne sera pas maintenir sa température pendant très longtemps et ajustements doivent être apportées à des intervalles fréquents de sur toutes les 20 à 30 min. Pour cela, il peut être nécessaire à la pipette une partie de l’eau dans la baignoire et ajouter plus de glace et d’additif.
| Substance | g/100 g H2O | Température finale (° C) |
| Na2CO3 | 20 | -2,0 |
| NH4pas3 | 106 | -4,0 |
| CNA2H3O2 | 85 | -4,7 |
| NH4Cl | 30 | -5,1 |
| NaNO3 | 75 | -5,3 |
| Na2S2O3 ● 5 H2O | 110 | -8,0 |
| CaCl2 ● 6 H2O | 41 | -9,0 |
| KCl | 30 | -10,9 |
| KI | 140 | -11,7 |
| NH4pas3 | 60 | -13,6 |
| NH4Cl | 25 | -15,4 |
| NH4pas3 | 45 | -16,8 |
| NH4YVERT | 133 | -18,0 |
| NaCl | 33 | -21,3 |
| CaCl2 ● 6 H2O | 81 | -21,5 |
| H2SO4 (66,2 %) | 23 | -25 |
| NaBr | 66 | -28 |
| H2SO4 (66,2 %) | 40 | -30 |
| C2H5OH (4°) | 105 | -30 |
| MgCl2 | 85 | -34 |
| H2SO4 (66,2 %) | 91 | -37 |
| CaCl2 ● 6 H2O | 123 | -40.3 |
| CaCl2 ● 6 H2O | 143 | -55 |
Le tableau 1. Sel/glace refroidissement des mélanges qui sont obtenues en mélangeant les sels avec l’eau ou de glace à la température spécifiée et dans les quantités spécifiées. 1
2. faire un bain de glace carbonique
- Chaussez cryogéniques protection gants et des lunettes de sécurité. Toujours cette pratique lors de la manipulation de glace sèche et jamais le toucher avec les mains nues car il peut rapidement brûler la peau et causer des engelures.
- Pour un navire de la baignoire avec un volume d’environ 1 litre, prendre environ 1/3 d’un bloc de glace sèche (habituellement disponible en blocs d’environ 2 lb) et briser en plusieurs petits morceaux.
- Ajoutez les morceaux de glace sèche dans la cuve de la baignoire.
- Ajouter lentement le solvant organique (par exemple l’acétone) à la neige carbonique en remuant avec une baguette de verre. Il y a un pétillement vigoureux à la suite de développement de gaz CO2 .
- Continuer lentement ajouter solvant et remuer jusqu'à ce que la forme une boue homogène et la plus grande partie de la glace carbonique dissout. Il s’agit d’assurer que le transfert de chaleur dans le ballon de réaction est aussi uniform que possible.
- Insérez un thermomètre de température froide dans la baignoire pour s’assurer que la température désirée est atteinte.
- Vérifiez sur le sec-glace-bain à intervalles réguliers et ajouter plus de morceaux de glace sèche lorsqu’une augmentation de la température du bain est remarqué. L’intervalle de temps dépend du degré d’isolation, mais est généralement autour de chaque 45 à 60 min.
3. faire un bain d’azote liquide
- Chaussez cryogéniques protection gants et des lunettes de sécurité. Toujours cette pratique lors de la manipulation de l’azote liquide car il peut brûler rapidement peau tissus et les fluides de l’oeil, provoquant des engelures ou lésions permanentes aux yeux.
- Pour un bain sans additifs, ajouter la quantité appropriée de la N2 à un Dewar pour obtenir une température de-196 ° C. Passez à l’étape 3.3 si il s’agit de la température désirée.
- Pour un bain avec additifs, ajouter un solvant organique de choix (consulter le tableau 3 pour trouver le bon solvant pour la bonne température) à la Dewar tout d’abord, puis ajouter lentement le liquide N2 au solvant.
- Insérez un thermomètre de température froide dans la baignoire pour s’assurer que la température désirée est atteinte. À la différence des autres thermes, le liquide N2 salles de bain à l’intérieur d’un Dewar maintient sa température pendant des heures à la fois.
- Vérifiez sur le bain à des intervalles appropriés (quelques heures) pour voir si plus N2 est nécessaire.
Certaines réactions chimiques doivent être effectuées sous la température ambiante pour la sécurité ou pour obtenir le produit désiré.
Un bain de refroidissement permet un système à être maintenus à une certaine plage de température pendant la durée de la réaction. Ceci est réalisé en plaçant le ballon à réaction dans le bain, la réaction de refroidissement sans jamais avoir de contact direct avec les réactifs.
Le bain est généralement un bâtiment bien isolé comme un flacon de Dewar contenant les composants cryogéniques nécessaires pour atteindre la température souhaitée. Dans les installations simples comme celui-ci, la température n’est pas stable, et la baignoire doit être contrôlée et ajustée tout au long de la procédure.
Cette vidéo explore les différents bains de refroidissement régulièrement utilisés pour réaliser des réactions sous la température ambiante.
Au cours d’une réaction chimique l’espèce en cause doit se heurtent pour nouvelles liaisons. Élévation de la température augmente l’énergie interne du système et provoque ces espèces de se déplacer plus rapidement, ce qui signifie qu’ils entreront en collision plus souvent. En conséquence, réactions se produisent plus rapidement à des températures élevées.
Toutefois, dans certains cas, il est souhaitable de réaliser des réactions à basse température, en dépit de l’abaissement de la vitesse de réaction. Par exemple, certaines réactions sont trop vigoureuses et doivent être refroidies pour éviter les fuites et de génération de pression vers le haut. Une réaction fortement exothermique pourrait également rapidement débordé et jaillir si ne pas refroidi, créant un danger pour la sécurité.
Refroidissement peut être utilisé pour fournir un avantage économique. Par exemple, empêche l’ébullition à partir d’un solvant ou la décomposition d’un réactif permet d’économiser temps et ressources.
Refroidissement est aussi fréquemment utilisé comme contrôle quel produit est cédé par une réaction qui a concurrence des voies. Dans ces réactions la voie avec la plus faible énergie d’activation est générée aux basses températures, tandis que la voie avec l’énergie d’activation plus haut est préférable à des températures élevées.
Maintenant que vous comprenez l’importance de l’exécution de réactions sous la température ambiante, nous allons jeter un coup d’oeil à la façon de préparer les différents types de bains de refroidissement.
Bains d’eau glacée sont faciles à mettre en place et sont disponibles dans l’enseignement de chaque laboratoire de chimie. Alors que la glace-eau, lui-même a une température de 0 ° C, un abaissement du point de fusion est possible par l’ajout de certains sels.
Cela permet des bains d’eau glacée pour atteindre une température de-40 ° C. La température finale peut être ajustée en augmentant ou en diminuant la concentration de sel additif.
Pour configurer un bain d’eau glacée, commencer par peser les quantités appropriées de glace et sel additif, comme indiqué dans le tableau de glace-bain figurant dans le protocole du texte.
Ensuite, ajoutez le sel à la glace. Versez une petite quantité d’eau déionisée dans le conteneur. À l’aide d’un agitateur, bien mélanger le bain.
Maintenant que la baignoire a été mises en place, vérifiez avec un thermomètre pour s’assurer que la température désirée est atteinte. Si ce n’est pas le cas, ajouter plus de sel que nécessaire. Lorsque la température voulue est atteinte, placer la cuve de réaction dans le bain de glace.
Bains d’eau glacée ne pas conserver leur température depuis longtemps et ont besoin d’être ajusté toutes les 20 à 30 min. Pour maintenir la température de la cible, il peut être nécessaire d’enlever l’eau liquide et ajouter plus de glace et de sel.
Pour des températures jusqu'à-78 ° C, des bains de glace sèche sont utilisés. La glace sèche est dioxyde de carbone solide, donc-transfert de chaleur efficace de celle-ci dans une cuve de réaction nécessite un solvant. Parce que la glace carbonique se sublime à-78 ° C, un solvant avec un point de congélation inférieur qui doit être utilisé si cette température doit être atteint. Solvants avec des points de congélation plus élevé peuvent être utilisés pour créer les plus chaudes carboglace bains. Pour préparer un bain de glace sèche, commencez par mettre sur cryogéniques protection gants et des lunettes de sécurité. Ne laissez jamais de carboglace touch peau nue.
Pour un bain de 1 L, obtenir environ 1/3 d’un bloc de glace sèche et casser en petits morceaux dans le récipient.
Ensuite, ajouter lentement le solvant organique choisi à la glace sèche en remuant avec une baguette de verre. Il y aura un pétillement vigoureux comme le gaz carbonique se développe.
Continuer d’ajouter lentement le solvant et remuer jusqu'à ce que la plupart de la glace carbonique se dissout, formant une pâte homogène. Cela garantit que le transfert de chaleur dans le ballon de réaction est aussi uniforme que possible.
Utilisez un thermomètre de température froide ou thermocouple, veiller à ce que le bain a atteint la température désirée, puis placez la cuve dans le bain.
Surveiller le bain à intervalles réguliers et ajouter les morceaux de glace sèche quand une augmentation de la température du bain est remarquée.
Enfin, lorsque la température du bain désirée est inférieure à quelle glace sèche peut fournir, l’azote liquide est utilisé. Azote liquide a un point de fusion de-196 ° C, et solvants sont nécessaires uniquement lorsque vous créez des bains chauds.
En raison des températures extrêmement basses de l’azote liquide, un Dewar est le seul acceptable.
Pour préparer un bain de refroidissement azote liquide, commencez par mettre des lunettes et des gants de protection cryogénique. Faites attention lorsque vous manipulez l’azote liquide, car il peut causer des engelures et des lésions oculaires permanente.
Pour un bain avec additifs, déterminer le solvant organique approprié pour la température voulue, comme indiqué dans le tableau de l’azote liquide trouvé dans le texte. Ajouter le solvant à le Dewar, puis ajouter lentement l’azote liquide.
Insérer un thermomètre à basse température ou thermocouple la baignoire pour s’assurer que la température désirée est atteinte. Ensuite, placez la cuve dans le bain.
Pour un bain sans additifs, il suffit d’ajouter la quantité appropriée d’azote pour le Dewar pour obtenir des températures aussi basses que -196 ° C .
Surveiller le bain à intervalles réguliers pour voir si l’azote supplémentaire est nécessaire.
Beaucoup de différents types de réactions à travers divers disciples scientifiques utilise des bains de refroidissement pour fonctionner sous la température ambiante.
Procédés de laboratoire mécanique, tout comme les réactions très exothermiques, peuvent également créer chaleur indésirable.
Dans cet exemple, tetrasilicate de baryum de cuivre en vrac a été préparé par les deux à l’état solide et fondre les flux de synthèse. Ensuite, ces matériaux stratifiés ont été exfoliée en utilisant des techniques de sonication.
Sonication utilise des ondes sonores pour agiter les particules. Cependant, parce que c’est un processus de haute énergie, il peut créer des excès de chaleur dans un échantillon.
Par conséquent, un bain d’eau glacée a été utilisé pour refroidir l’échantillon au cours du processus de sonication d’une heure. Empêchant cet excès chauffage assure l’intégrité et la cohérence du rendement du produit.
Dans cet exemple, un bain de glace sèche servait à faire en sorte que diiodomethyllithium a été synthétisé par déprotonation du diiodométhane.
Réactifs ont été ajoutés dans un ballon à fond rond contenant une barre de remuer. Ensuite, le ballon à fond rond a été placé dans un Dewar. Glace et l’acétone ont été ajoutés à la Dewar, et l’ensemble de l’appareil était couvert pour minimiser l’exposition à la lumière. Maintenir le système faible énergie était essentiel pour la stabilité du produit.
Bains de glace sèche et liquide de l’azote sont fréquemment utilisés comme pièges de condenser les échantillons. En particulier, ces pièges peuvent aider la sécurité du transport des composés sensibles à air tout en empêchant la contamination du matériel. Dans cet exemple, un piège à azote liquide froid servait à condenser un échantillon sensible volatile et l’oxydation, pour une préparation ultérieure pour l’analyse de la masse spectrometrical.
Le système a été d’abord nettoyé et chauffé, pour enlever les contaminants potentiels. Le tube à essai verrouillable était alors submergé dans l’azote liquide, afin de permettre la condensation de l’échantillon à travers la ligne de Schlenk. L’échantillon a été ensuite retirée pour l’analyse par spectrométrie de masse.
Vous avez juste regardé introduction de JoVE pour effectuer des réactions sous la température ambiante. Vous devez maintenant comprendre eau glacée, glace carbonique et azote liquide refroidissement des bains, et pourquoi ils sont chimiquement importants.
Merci de regarder !
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Quand est-il utile d’exécuter une réaction à une basse température ?
Afin de répondre à cette question nous laisse enquêter sur quatre différentes applications :
Application 1. Parfois, les réactions sont trop vigoureux et exothermique et le mélange réactionnel doit être refroidi afin d’éviter les fuites et la montée en raison de l’exploitation du gaz en pression. Une réaction fortement exothermique peut également devenir un danger pour la sécurité, comme le mélange réactionnel peut déborder rapidement (de nombreux solvants organiques ont généralement faible point d’ébullition) et jaillir. A très souvent recours pour cela est l’extinction ou la marche à suivre étape où une réaction initialement effectuée dans des conditions anhydres réagit avec de l’eau et d’acide à la fin afin de protoner le produit final et de réagir à toute autres intermédiaires réactifs et réactifs. Par exemple, dans la réaction de Grignard, une réaction très courante en chimie organique, l’étape de refroidissement à la fin exigera de refroidissement, même si un bain d’eau glacée à 0 ° C est suffisante :
(4)
Demande 2. Refroidissement peut également être requis pour les étapes d’ajout au début d’une réaction, lorsqu’une réaction exothermique dans le cas contraire provoquerait l’ébullition du solvant organique. C’est pas souhaitable, car les réactions sont mieux réalisées dans des solvants. Avoir à ajouter un solvant plus pour compenser la perte de solvant est non seulement inutile et non rentable mais aussi fastidieux comme solvants dans de nombreuses réactions nécessitent un avant l’étape de séchage pour les rendre anhydre. En outre, il est possible pour certains réactifs se décompose thermiquement à des températures élevées.
Pour éviter ces événements dans une réaction exothermique, un réactif est souvent ajouté goutte à goutte par seringue ou entonnoir dans une fiole contenant un autre réactif dans le solvant, tout en remuant et refroidissement. De cette façon, l’addition peut être arrêtée à tout moment si la réaction devient trop vigoureuse. Souvent, la réaction doit être refroidie bien inférieure à 0 ° C et un bain d’eau glacée ne suffit pas.
Un exemple d’une réaction lorsque cela est nécessaire est l’ajout de la solide base n-butyllithium (n-BuLi) à diisopropylamine pour former le diisopropylamidure de lithium (LDA).
(5)
En l’absence d’un bain de refroidissement le n-BuLi peut se décomposer comme des températures plus élevées sont atteintes :
(6)
Demande 3. Dans certaines réactions chimiques, il y a plus d’un produit possible résultant d’une voie chimique. Un produit peut être le résultat de la voie avec un état de transition plus stable exigeant moins d’activation énergétique (Ea1), tandis que l’autre produit peut nécessiter plus d’énergie d’activation (Ea2), mais est globalement plus stable. Le premier s’appelle le produit cinétique tandis que celle-ci est appelée produit thermodynamique (TD) (voir diagramme d’énergie à la Figure 2).
En contrôlant la température de réaction, nous pouvons contrôler que l'on de ces produits est formé. Parce que le produit cinétique nécessite moins d’énergie d’activation, c’est le produit qui se forment à basse température. Réalisation d’une réaction à des températures basses souvent assure la formation du produit cinétique sur le produit thermodynamique.
Un exemple classique dans le domaine de la chimie de l’énolate est la réaction du 2-méthylecyclohexanone avec différentes bases sous différentes conditions de réaction. Le réactif est une cétone dissymétrique et possède donc deux types différents d’hydrogènes-α. Petites bases, tels que NaOH déprotoner la cétone sur le côté plus-fortement substitué, qui se traduit par l’énolate plus stable, thermodynamique (7). Bases, qui réclament plus stériquement, déprotoner la cétone sur le côté moins encombrée, ayant pour résultat l’énolate cinétique (8). La formation de l’énolate cinétique auront un rendement beaucoup plus élevé lorsque la réaction est réalisée à-78 ° C par rapport à la température ambiante. Les deux formes de l’énolate peuvent ensuite faire réagir avec un électrophile approprié, tels que methyiodide, pour former les produits α-alkylés, illustrées ci-dessous.
(7) (8)
La base stériquement exigeante permet d’obtenir l’énolate cinétique est souvent LDA, dont l’élaboration a été montrée plus tôt dans le régime (5). Il est important de contrôler la température à-78 ° C afin d’empêcher l’énolate cinétique s’équilibrer dans l’énolate thermodynamique. (Note : il n’y a aucune signification à une température de-78 ° C sauf qu’elle est facilement obtenue par un bain de glace sèche dans l’acétone.)
En dehors du contrôle de la température, l’ordre de l’addition et la manière d’addition des réactifs est crucial. Pour de meilleurs résultats favorisant l’énolate cinétique, on ajoute une solution de réactif cétone goutte à goutte à la base de la LDA dans le solvant. Le solvant anhydre, utilisé pour la réaction avec le LDA est souvent THF. Une réaction de l’exemple est montrée dans le schéma (9).
(9)

La figure 2. Diagramme d’énergie d’une réaction qui a une cinétique et un produit thermodynamique.
Demande 4. Dans certains cas, il est possible de réglementer les réactivités des réactifs avec la température. Considérons par exemple la réduction d’un ester. Réactions avec le fort hydrure agent réducteur LiAlH4 (LAH) entraîner une réduction de l’ester tout le chemin jusqu'à l’alcool primaire respectif (10). Cependant, utilisation de l’hydrure de diisobutylaluminium hydrure encombrants agent réducteur (DIBAL) permet la réduction sélective d’un ester à l’aldéhyde respectif. Une réduction excessive de l’alcool primaire peut être évitée, tant que la température de réaction est maintenue en permanence à au-dessous de-78 ° C (encore mieux vers le bas à-90 ° C) et seulement un équivalent stoechiométrique de DIBAL est utilisé (12). À des températures supérieures à-70 ° C, DIBAL devient trop réactif et réduira l’ester à l’alcool primaire (11).
(10)-(12)
Subscription Required. Please recommend JoVE to your librarian.
References
- Gordon, A. J., Ford, R. A. The Chemist's Companion - A Handbook of Practical Data, Techniques, and References. Chapter 11 (1973) ISBN: 978-0-471-31590-2.
- Rondeau, R. E. Slush baths. J. Chem. Eng. Data. 11, 124 (1966)




