Overview
Fonte: Tamara M. Powers, Dipartimento di Chimica, Texas A & M University
Nel 1951, Kealy e Pauson riferirono a Nature la sintesi di un nuovo composto organometallico, il ferrocene. 1 Nel loro rapporto originale, Pauson suggerì una struttura per il ferrocene in cui il ferro è legato solo (legami sigma) a un atomo di carbonio di ciascun ligando ciclopentadiene (Figura 1, Struttura I). 1,2,3 Questo rapporto iniziale ha portato a un interesse diffuso per la struttura del ferrocene, e molti scienziati di spicco hanno partecipato alla spiegazione della struttura di questa interessante nuova molecola. Wilkinson e Woodward si sono affrettati a suggerire una formulizzazione alternativa in cui il ferro è "inserito" tra due ligandi ciclopentadienici, con uguale legame a tutti i 10 atomi di carbonio (Figura 1, Struttura II). 4 Qui, sintetizzaremo il ferrocene e decideremo, sulla base di dati sperimentali (IR e 1H NMR), quale di queste strutture viene osservata. Inoltre, studieremo l'elettrochimica del ferrocene raccogliendo un voltammogramma ciclico. Nel corso di questo esperimento, introduciamo la regola dei 18 elettroni e discutiamo il conteggio degli elettroni di valenza per i complessi di metalli di transizione.
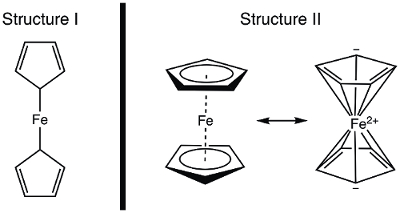
Figura 1. Due strutture proposte di ferrocene.
Principles
Regola dei 18 elettroni e conteggio totale degli elettroni di valenza:
Quando si disegnano le strutture a punti di Lewis, è importante ricordare la regola dell'ottetto, che afferma che gli atomi degli elementi del gruppo principale hanno 8 elettroni nel loro guscio di valenza. Tuttavia, la regola dell'ottetto non vale per i metalli di transizione, che hanno nove orbitali di valenza (uno s,tre pe cinque orbitali d) e possono quindi ospitare fino a 18 elettroni. Pertanto, una regola di 18 elettroni si applica ai complessi di metalli di transizione. Come la regola dell'ottetto, ci sono eccezioni alla regola dei 18 elettroni, ma in generale, i complessi di metalli di transizione con 18 elettroni di valenza sono considerati composti altamente stabili.
Esistono due metodi che possono essere utilizzati per determinare il conteggio totale degli elettroni di valenza di un complesso di metalli di transizione: il modello ionico (carico) e il modello covalente (neutro). 5 La corretta applicazione di entrambi i metodi dovrebbe dar luogo allo stesso numero totale di elettroni. Entrambi i modelli utilizzano tre classificazioni di ligandi chiamate tipi X, L e Z. Ogni tipo di ligando contribuisce con un numero diverso di elettroni al conteggio totale degli elettroni e dipende dal metodo utilizzato. I ligandi di tipo X includono gruppi anionici come alogenuri, idrossido e alcossidi. I ligandi di tipo L includono donatori a coppie solitarie come ammine e fosfine. Infine, i ligandi di tipo Z sono accettori di coppie di elettroni; pertanto, i ligandi di tipo Z sono acidi di Lewis neutri, come BR3. Considereremo la molecola Co(NH3)3Cl3 al fine di dimostrare i due metodi (Figura 2).

Figura 2. Esempio di conteggio degli elettroni, Co(NH3)3Cl3.
Modello ionico:
Innanzitutto, considera il numero di elettroni forniti dall'atomo centrale. Co è nel gruppo 9 della tavola periodica e quindi ha 9 elettroni di valenza. Nel modello ionico, lo stato di ossidazione del metallo deve essere considerato. Poiché lo stato di ossidazione del Co in Co(NH3)3Cl3 è +3, il numero totale di elettroni di valenza forniti dal metallo nel modello ionico è 6 e−(Tabella 1). Nel modello ionico, entrambi i ligandi di tipo X e L donano 2 e− al conteggio totale degli elettroni mentre i ligandi di tipo Z non contribuiscono con elettroni. Per l'esempio Co(NH3)3Cl3, sono presenti due tipi di ligando. Cl è un ligando di tipo X e NH3 è un ligando di tipo L. Usando il modello ionico, il conteggio totale degli elettroni è 18 e− (Tabella 1).
Tabella 1. e− conteggio di Co(NH3)3Cl3 utilizzando i modelli ionico e covalente
| Ligando/atomo centrale | Tipo di ligando |
e− contributo
(modello ionico) |
e− contributo
(modello covalente) |
| Co | n/d | 6 e− | 9 e− |
| 3 NH3 | L | 3 x (2 e−) | 3 x (2 e−) |
| 3 Cl | X | 3 x (2 e−) | 3 x (1 e−) |
| Carica di ione | n/a* | − (0) | |
| Totale e− conteggio | 18 e− | 18 e− | |
*La carica dello ione contenente metallo NON è inclusa nel conteggio totale degli elettroni utilizzando il modello ionico. La carica è rappresentata nello stato di ossidazione del metallo (elettroni forniti dall'atomo centrale).
Modello covalente:
Per il modello covalente, il contributo e− dell'atomo centrale è uguale al numero totale di valenza e− per l'atomo neutro (in questo caso 9 e−). I ligandi di tipo X donano 1 e−, i ligandi di tipo L donano 2 e−e i ligandi di tipo Z donano 0 e−. Infine, se la molecola è ionica, la carica dello ione contenente il centro metallico deve essere sottratta dal metallo più gli elettroni del ligando. Usando il modello covalente, il conteggio totale degli elettroni per Co(NH3)3Cl3 è anche 18 e− (Tabella 1).
Conteggio degli elettroni per ferrocene e catione ferrocenio:
Usando il modello covalente, Fe ha 8 e−. Se consideriamo il legame nel ferrocene come quello nella Struttura I, i ligandi ciclopentadienici (Cp) sono donatori di tipo X e quindi ciascuno contribuisce con 1 elettrone (Tabella 2). Quindi, avremmo 10 elettroni di valenza. Tuttavia, nella Struttura II, ogni anello Cp dona 5 elettroni (ligando di tipo L2X), dove abbiamo due doppi legami (ciascuno sono donatori di 2 elettroni, di tipo L) e un donatore di tipo X (il radicale). Questo dà un totale di 18 elettroni (Tabella 2).
Tabella 2. Conteggio degli elettroni per il ferrocene (Fc) e il ferrocenio (Fc+) catione utilizzando il modello covalente
| Ligando/atomo centrale | Struttura I | Struttura II | ||||
| Tipo di ligando | Fc | FC+ | Tipo di ligando | Fc | FC+ | |
| Fe | -- | 8 e− | 8 e− | -- | 8 e− | 8 e− |
| Cp | X | 2 x (1 e−) | 2 x (1 e−) | L2X | 2 x (5 e−) | 2 x (5 e−) |
| Carica di ione | − (0) | − (+1) | Carica di ione | − (0) | − (+1) | |
| Conteggio totale degli elettroni | 10 e− | 9 e− | Conteggio totale degli elettroni | 18 e− | 17 e− | |
Il ferrocene subisce prontamente un'ossidazione 1 e− per produrre catione ferrocenio (Equazione 1).
 (1)
(1)
Consideriamo il conteggio degli elettroni risultante per il catione di ferrocenio delle strutture I e II. In caso di ossidazione 1 e−, il ferrocene diventa ionico. Pertanto, la carica (+1) del catione ferrocenio deve essere sottratta dagli elettroni di valenza (Tabella 2). Sottraendo la carica si traduce in conteggi totali di elettroni di 9 e− e 17 e− per la Struttura I e la Struttura II, rispettivamente.
Quale struttura del Ferrocene è corretta?:
Se la Struttura I è corretta, con solo 10 elettroni di valenza, il ferrocene sarebbe altamente reattivo al Fe. L'ossidazione per produrre il catione ferrocenio sarebbe piuttosto impegnativa in questo caso, poiché la Struttura I del ferrocene è carente di elettroni. D'altra parte, la Struttura II del ferrocene obbedisce alla regola dei 18 elettroni ed è quindi coerente con il ferrocene che è un composto stabile. In questo caso, l'ossidazione del ferrocene a catione ferrocenio produrrebbe una specie 17 e −. Sulla base del conteggio degli elettroni, si può prevedere che il ferrocene mostri la Struttura II; pensiamo a come dimostrare la struttura corretta spettroscopicamente.
Prima della pubblicazione dei dati strutturali, la struttura del ferrocene è stata dedotta dalle sue proprietà magnetiche e spettroscopiche, nonché dalla sua reattività. Consideriamo gli spettri IR che prediremmo per le due strutture. La struttura I mostra due protoni chimicamente inequivalenti e dovrebbe quindi dare origine a più di una modalità di allungamento C-H nello spettro IR. Al contrario, la Struttura II mostra un singolo tipo di legame C-H e dovrebbe quindi visualizzare un singolo allungamento C-H. Se la spettroscopia NMR fosse stata prontamente disponibile nel 1950, anche questo avrebbe fornito un indizio: due risonanze nello spettro 1H per la Struttura I e una risonanza per la Struttura II sarebbero state previste. In questo esperimento, sintetizzaremo il ferrocene e utilizzeremo dati spettroscopici per fornire prove della sua struttura.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Cracking del ciclopentadiene dimero (Figura 3)
Cyclopentadiene subisce una reazione Diels-Alder con se stesso per dare diciclopentadiene. Questa reazione è reversibile, quindi il cracking viene effettuato utilizzando il principio di La Châtelier per guidare la reazione inversa distillando il monomero ciclopentadiene (b.p. 42 °C) lontano dal dimero diciclopentadiene (b.p. 170 °C). La reazione di dimerizzazione è lenta quando il ciclopentadiene viene mantenuto freddo, ma deve essere preparato al momento per sintetizzare con successo il ferrocene.
- Per un matraccio a fondo tondo da 25 mL, aggiungere una barra di agitazione e 10 mL di dimero di diciclopentadiene.
ATTENZIONE: Fare attenzione a utilizzare solo diciclopentadiene e ciclopentadiene in una cappa aspirante perché sono entrambi prodotti chimici di puzza. - Attaccare il matraccio a fondo tondo a un apparecchio di distillazione frazionata (vedere il modulo "Distillazione frazionata" nella serie Essentials of Organic Chemistry) e metterlo in un bagno d'olio su una piastra calda di agitazione. Assicurati di avere le fiasche di raccolta in un bagno di ghiaccio. Bloccare l'apparecchio in posizione.
- Impostare la piastra calda a 160 °C e mescolare delicatamente la soluzione.
- Distillamento frazionario ~ 5 mL del monomero Cp dal dimero (39-42 °C).

Figura 3. Cracking di diciclopentadiene.
2. Sintesi del Ferrocene (Figura 4)
- Su un pallone Schlenk da 100 ml, aggiungere una barra di agitazione e 15 g di KOH finemente macinato.
ATTENZIONE: KOH è molto corrosivo e igroscopico! Il KOH deve essere macinato in una cappa ben ventilata e utilizzato immediatamente dopo la preparazione. - Aggiungere 30 mL di 1,2-dimetossietano al matraccio mescolando.
- Collegare il matraccio all'azoto e posizionare un setto di gomma sul collo del pallone.
- Mescolando sotto azoto, aggiungere 2,75 mL di ciclopentadiene tramite siringa. Lasciare mescolare per almeno 10 minuti prima dell'aggiunta del ferro.
- Mentre la reazione si muove, aggiungere una barra di agitazione, 3,25 g di FeCl2·4H2O macinato e 12,5 mL dmSO in un matraccio Schlenk separato da 50 mL. Metti un setto sul collo e mescola sotto azoto fino a quando tutto il ferro si è sciolto.
- La cannula trasferisce la soluzione di ferro alla soluzione ciclopentadienile sotto azoto a goccia nel corso di 30 minuti. Per una procedura più dettagliata, si prega di rivedere il video "Sintesi di un metallocene Ti(III) usando la tecnica della linea di Schlenk" in questa serie di chimica inorganica.
- Una volta completata l'aggiunta, mescolare per altri 30 minuti.
- Nel frattempo, in un becher raffreddare 45 mL di 6 M HCl aggiungendo ghiaccio tritato (50 g) direttamente alla soluzione.
- Una volta completata la reazione, versare la miscela sul liquame e mescolare per alcuni minuti. Dovrebbero formarsi cristalli arancioni.
- Raccogliere i cristalli su un imbuto Büchner (dotato di carta da filtro) e lavare il precipitato con acqua.
- Lasciare asciugare i solidi all'aria.

Figura 4. Sintesi del ferrocene.
3. Purificazione del Ferrocene. Purificare il prodotto per sublimazione (per una procedura più dettagliata, si veda il video "Purificazione del Ferrocene per Sublimazione").
4. Caratterizzazione del Ferrocene
- Preparare e raccogliere uno spettro NMR di 1H di ferrocene.
- Raccogliere uno spettro IR di ferrocene.
- Raccogli un voltammogramma ciclico del ferrocene (vedi il video "Voltammetria ciclica" nella serie Essentials of Analytical Chemistry).
La determinazione della struttura dei composti organometallici è fondamentale per comprendere la reattività di una determinata molecola. Vari modelli e tecniche consentono agli scienziati di chiarire i composti in questione, come ad esempio il ferrocene.
Il ferrocene, un composto organometallico, fu segnalato per la prima volta da Kealy e Pauson nel 1951. Hanno proposto una struttura costituita da un atomo di ferro con due singoli legami a due atomi di carbonio su anelli ciclopentadienici separati.
Tuttavia, Wilkinson e Woodward hanno suggerito un'alternativa per la struttura ferrocenicia, in cui l'atomo di ferro è "inserito" tra due anelli ciclopentadienici, con uguale legame a tutti i 10 atomi di carbonio. La struttura proposta da Wilkinson è stata da allora confermata dalla cristallografia a raggi X e dalla NMR protonica.
Questo video illustrerà la regola dei 18 elettroni per prevedere la struttura dei complessi organometallici, la sintesi del ferrocene, la sua analisi spettroscopica ed elettrochimica e alcune delle sue applicazioni.
Quando si propongono strutture molecolari, considerare sempre la quantità di elettroni del guscio di valenza. Gli elementi del gruppo principale possono ospitare fino a 8 elettroni, mentre i metalli di transizione possono contenere fino a 18 elettroni nel suo guscio di valenza. I metalli di transizione hanno nove orbitali di valenza, orbitali 1 s,3 pe 5 d, con due elettroni ciascuno. Con alcune eccezioni, i complessi di metalli di transizione con 18 elettroni di valenza sono composti altamente stabili.
Per determinare il numero totale di elettroni di un complesso di metalli di transizione, è possibile utilizzare due modelli: il metodo ionico o covalente. Entrambi i metodi utilizzano le stesse classificazioni dei ligandi: i ligandi di tipo X includono gruppi anionici come alogenuri, idrossido o alcossido; I ligandi di tipo L includono donatori a coppia solitaria come ammine e fosfine; e i ligandi di tipo Z sono acidi di Lewis neutri, che sono accettori di coppie di elettroni. Per dimostrare i due modelli, usiamo Co(NH3)3Cl3 come esempio.
Si consideri l'atomo di Co, che è nel gruppo 9 della tavola periodica e ha 9 elettroni di valenza. Poiché lo stato di ossidazione del cobalto in questo complesso è +3, il numero totale di elettroni di valenza forniti è 6.
I ligandi di tipo X, essendo i 3 Cl, e i ligandi di tipo L, i 3 NH3, contribuiscono per un totale di 12 elettroni, mentre i ligandi di tipo Z non sono disponibili - producendo un totale di 18 elettroni.
Nel modello covalente lo stato di ossidazione del cobalto viene ignorato e la molecola non è ionica, risultando in 9 elettroni totali. I ligandi di tipo X donano un elettrone; I ligandi di tipo L donano due elettroni; e i ligandi di tipo Z, se presenti, non contribuiscono a nessuno - producendo anche un totale di 18 elettroni.
Il conteggio degli elettroni totali nel ferrocene è più complesso: l'atomo di ferro contribuisce con 8 elettroni di valenza, mentre gli anelli ciclopentadienici sono classificati come ligandi di tipo L2X, fornendo 5 elettroni ciascuno, che provengono dai due doppi legami e da un radicale, per un totale di 18 elettroni. Mentre la struttura originale proposta da Pauson avrebbe portato a soli 10 elettroni, a causa dei singoli ciclopentadieni legati.
Ora che abbiamo discusso i principi della determinazione della struttura, sintetizzare il ferrocene e identificare quale struttura è corretta.
In una cappa aspirante, aggiungere una barra di agitazione e 50 ml di diciclopentadiene a un pallone a fondo tondo da 100 mL bloccato. Quindi attaccare il pallone a fondo tondo a un apparecchio di distillazione e metterlo in un bagno d'olio, con il pallone ricevente in un bagno di ghiaccio.
Impostare la piastra calda a 160 °C e mescolare delicatamente. Distillare frazionalmente circa 5 ml di ciclopentadiene monomero, che deve essere mantenuto freddo.
Aggiungere a un pallone Schlenk da 200 ml etichettato A, una barra di agitazione e KOH appena macinato. Quindi, aggiungere 30 ml di 1,2-dimetossietano, collegare il pallone a una linea N2 e adattarlo a un setto di gomma.
Mescolando in atmosfera N2, aggiungere alla soluzione 2,75 mL di ciclopentadiene tramite siringa e mescolare per almeno 10 minuti.
In un matraccio Schlenk separato da 200 mL etichettato B, aggiungere FeCl2•4H2O macinato e 12,5 mL DMSO. Quindi montare un setto di gomma, attaccare a una linea N2 e mescolare sotto un'atmosfera N2 fino a quando tutto il ferro si è dissolto.
Quando questo passaggio è completo, inserire entrambe le estremità di un ago a doppia punta in ciascun matraccio Schlenk e la cannula trasferire la soluzione di ferro alla soluzione di ciclopentadiene a goccia per un periodo di 30 minuti.
Quando la reazione è completa, versare la miscela in un becher contenente un impasto di 6 M HCl e 50 g di ghiaccio tritato e mescolare per alcuni minuti. Raccogliere i cristalli arancioni risultanti mediante filtrazione sotto vuoto su un imbuto fritto, lavare il precipitato con acqua ghiacciata e quindi asciugare all'aria. Purificare i cristalli per sublimazione.
Quindi, preparare un campione NMR del ferrocene purificato disciolto in cloroformio-d. Utilizzare l'attacco ATR dello spettrometro a infrarossi per ottenere uno spettro IR. E, infine, raccogliere un voltammogramma ciclico del ferrocene in acetonitrile, ad una velocità di scansione di 100 mV/s.
L'analisi NMR mostra un singolo picco a 4,17 ppm, che conferma che tutti gli atomi di idrogeno sono magneticamente equivalenti. Inoltre, lo spettro IR mostra un singolo allungamento sp2 C-H a 3096 cm-1, confermando che gli atomi di idrogeno sono equivalenti e che la struttura di Wilkinson proposta è corretta.
Infine, diamo un'occhiata al CV del ferrocene, che mostra un singolo evento di ossidazione. Il mezzo valore E1/2 può essere calcolato prendendo la media del potenziale di picco catodico e del potenziale di picco anodico. Nell'acetonitrile, la coppia ferrocene/ferrocenio redox si verifica ad un potenziale di 90 mV.
Ora che abbiamo discusso una procedura per preparare il ferrocene, diamo un'occhiata ad alcune delle sue applicazioni.
Le reazioni di accoppiamento incrociato catalizzato dal palladio sono un prezioso strumento sintetico nell'industria farmaceutica. Tuttavia, una reazione collaterale indesiderata comune è l'eliminazione del beta-idruro, che può essere minimizzata con l'uso di 1,1'-bis(difenilfosfino)ferrocene o dppf come agente chelante con PdCl2, formando [1,1'-Bis(difenilfosfino)ferrocene]palladio(II) dicloruro abbreviato in (dppf)PdCl2.
La soppressione dell'eliminazione del beta-idruro e l'elevata resa del prodotto sono state attribuite all'ampio angolo di morso del ligando dppf. Con l'avvento del catalizzatore, reazioni come l'accoppiamento Suzuki, sono possibili e tipicamente utilizzate per accoppiare gruppi alchilici primari utilizzando reagenti 9-BBN.
La facilità con cui il ferrocene può subire una sostituzione aromatica elettrofila, come nell'acilazione di Friedel-Crafts, o nella reazione di fornilazione/Mannich, lo ha reso una fonte promettente per i candidati farmaci organometallici. Questi tipi di farmaci organometallici hanno attirato l'interesse a causa della loro varietà strutturale. Ad esempio, M-arenes può supportare tre funzionalità e M-carbenes può supportare due.
Attualmente la ferrochina, che contiene elementi di ferrocene e clorochina, è in fase di valutazione come farmaco antimalarico commerciale. Inoltre, il ferrocifene, che si basa sugli elementi del ferrocene e del tamoxifene, è attualmente in fase di sperimentazione clinica come potenziale farmaco per il cancro al seno. Inoltre, si stanno compiendo sforzi nello sviluppo di analoghi nucleosidici del ferrocene nello studio delle vie DNA/RNA.
Hai appena visto l'introduzione di JoVE alla struttura del ferrocene. Ora dovresti capire la regola dei 18 elettroni, la sintesi e la caratterizzazione del ferrocene e molte delle sue applicazioni. Grazie per l'attenzione!
Subscription Required. Please recommend JoVE to your librarian.
Results
Caratterizzazione ferroceno:
1 H NMR (cloroformio-d, 300 MHz, δ, ppm): 4.15 (s).
Lo spettro NMR 1H del ferrocene mostra chiaramente una singola risonanza, coerente con la struttura II.
Di seguito è riportato un CV di ferrocene. Il valore E1/2 ottenuto per l'ossidazione del ferrocene è stato di +90 mV (acetonitrile, scan rate 100 mV/s, 0,1 M (Bu4N)PF6,elettrodo di lavorazione del carbonio vetroso). La coppia redox ferrocene/ferrocenio è comunemente usata come riferimento nella voltammetria ciclica. Se usato come riferimento, il valore E1/2 del ferrocene è impostato su 0 V.

Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
In questo video, abbiamo discusso del ferrocene e del ruolo che ha svolto nello sviluppo della chimica organometallica. Il ferrocene è stato sintetizzato e caratterizzato da 1H NMR e spettroscopia IR. Entrambi gli spettri sono coerenti con la 18 e− Struttura II, dove il ferro è "inserito" tra due ligandi ciclopentadienici, con uguale legame a tutti i 10 atomi di carbonio (Figura 1, Struttura II). L'ossidazione del ferrocene al catione ferrocenio è stata osservata elettrochimicamente.
Nel 1973, in seguito alla caratterizzazione strutturale del ferrocene, Wilkinson fu uno dei due chimici insigniti del Premio Nobel per la Chimica "per il [suo] lavoro pionieristico ... sulla chimica degli organometallici, i cosiddetti complessi sandwich". 6 Il suo lavoro influenzò e ampliò notevolmente il campo emergente della chimica organometallica. Mentre il primo composto organometallico è stato preparato nel 1849, è stato solo nel 1950 che sono stati fatti progressi significativi per capire come i metalli possono legarsi agli atomi di carbonio. Oggi, il campo della chimica organometallica, o la chimica dei composti che formano legami metallo-carbonio, è centrale per molte applicazioni. Ciò include: energia, celle solari sensibilizzate al colorante, catalisi, polimerizzazione, scoperta e sintesi di farmaci, sistemi bioinorganici e diodi organici a emissione di luce (OLED). 7
Il ferrocene stesso svolge anche un ruolo attivo nel campo della chimica organometallica. Il ferrocene partecipa prontamente alla sostituzione elettrofila aromatica; infatti, è 100.000 volte più reattivo del benzene in queste reazioni. Il ferrocene ha trovato ampia applicazione come componente strutturale dei ligandi bidentati nella catalisi organometallica. Ad esempio, l'1,1'-bis(difenilfosfino)ferrocene (dppf) è un ligando chelante utilizzato nella catalisi omogenea. Il ligando dppf chela i metalli di transizione1°,2°e 3° fila tra cui Ni, Pd e Pt. [1,1'-Bis(difenilfosfino) ferrocene]palladio(II) dicloruro è un esempio di catalizzatore di accoppiamento incrociato di palladio per la formazione di legami C-C e C-eteroatomo (Figura 5). 8 Nel video "MO Theory of Transition Metal Complexes", sintetizzaremo due complessi metallici con dppf.

Figura 5. Il dicloruro di [1,1'-Bis(difenilfosfino) ferrocene]palladio(II) è un catalizzatore ad accoppiamento incrociato per la formazione di legami C-C e C-X.
Subscription Required. Please recommend JoVE to your librarian.
References
1. Kealy, T. J., Pauson, P. L. A New Type of Organo-Iron Compound. Nature. 168 (4285), 1039-1040 (1951).
2. Pauson, P. L. Ferrocene—how it all began. J Organomet Chem. 637, 3-6 (2001).
3. Seeman, J. I., Cantrill, S. Wrong but seminal. Nat Chem. 8 (3), 193-200 (2016).
4. Wilkinson, G., Rosenblum, M., Whiting, M. C., Woodward, R. B. The Structure of Iron Bis-cyclopentadienyl. 74, 2125-2126 (1952).
5. Green, M. L. H., Parkin, G. Application of the Covalent Bond Classification Method for the Teaching of Inorganic Chemistry. J Chem Educ. 91 (6), 807-816 (2014).
6. Press Release. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/1973/press.html.
7. Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 6th ed. John Wiley & Sons. Hoboken. 2014.
8. Gildner, P. G., Colacot, T. J. Reactions of the 21st Century: Two Decades of Innovative Catalyst Design for Palladium-Catalyzed Cross-Couplings. Organometallics. 34, 5497-5508 (2015).




