Source: Hannah L. Cebull1, Arvin H. Soepriatna1, John J. Boyle2 et Craig J. Goergen1
1 Fois Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
2 (en) Génie mécanique et science des matériaux, Université de Washington à St. Louis, St Louis, Missouri
Le comportement mécanique des tissus mous, tels que les vaisseaux sanguins, la peau, les tendons et d'autres organes, sont fortement influencés par leur composition d'élastine et de collagène, qui fournissent élasticité et force. L'orientation des fibres de ces protéines dépend du type de tissu mou et peut aller d'une seule direction préférée à des réseaux maillés complexes, qui peuvent devenir altérés dans les tissus malades. Par conséquent, les tissus mous se comportent souvent anisotropically au niveau cellulaire et d'organe, créant un besoin pour la caractérisation tridimensionnelle. Il est important de développer une méthode d'estimation fiable des champs de souches dans des tissus ou des structures biologiques complexes pour caractériser et comprendre mécaniquement la maladie. La souche représente la façon dont les tissus mous se déforment relativement au fil du temps, et il peut être décrit mathématiquement à travers diverses estimations.
L'acquisition de données d'image au fil du temps permet d'estimer la déformation et la tension. Cependant, toutes les modalités d'imagerie médicale contiennent une certaine quantité de bruit, ce qui augmente la difficulté d'estimer avec précision la souche in vivo. La technique décrite ici permet de surmonter ces problèmes avec succès en utilisant une méthode d'estimation de déformation directe (DDE) pour calculer spatialement différents champs de souches 3D à partir de données d'image volumétriques.
Les méthodes actuelles d'estimation des souches comprennent la corrélation d'image numérique (DIC) et la corrélation numérique du volume. Malheureusement, DIC ne peut estimer avec précision la souche d'un avion 2D, limitant gravement l'application de cette méthode. Bien qu'utiles, les méthodes 2D telles que le DIC ont de la difficulté à quantifier la souche dans les régions qui subissent une déformation 3D. C'est parce que le mouvement hors plan crée des erreurs de déformation. La corrélation numérique du volume est une méthode plus applicable qui divise les données de volume initiale en régions et trouve la région la plus similaire du volume déformé, réduisant ainsi l'erreur hors plan. Cependant, cette méthode s'avère sensible au bruit et nécessite des hypothèses sur les propriétés mécaniques du matériau.
La technique démontrée ici élimine ces problèmes en utilisant une méthode DDE, ce qui la rend très utile dans l'analyse des données d'imagerie médicale. En outre, il est robuste à souche élevée ou localisée. Ici, nous décrivons l'acquisition de données d'échographie 4D fermées et volumétriques, sa conversion en format analysable, et l'utilisation d'un code Matlab personnalisé pour estimer la déformation 3D et les souches green-Lagrange correspondantes, un paramètre qui décrit mieux les grandes déformations. Le tenseur de souche Green-Lagrange est mis en œuvre dans de nombreuses méthodes d'estimation des souches 3D, car il permet de calculer F à partir d'un Least Squares Fit (LSF) des déplacements. L'équation ci-dessous représente le tenseur de souche Green-Lagrange, E, où F et moi représentons respectivement le gradient de déformation et le tenseur d'identité de deuxième ordre.
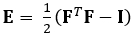 (1)
(1)
Biomedical Engineering
