4.8:
수용액 내 화학반응
4.8:
수용액 내 화학반응
화학 물질은 여러 가지 방법으로 상호 작용합니다. 특정 화학 반응은 반응성의 일반적인 패턴을 나타낸다. 화학 반응의 광대 한 수로 인해, 상호 작용의 관찰 된 패턴에 따라 그들을 분류 하는 것이 필요 해진다.
물은 많은 물질을 용해시킬 수있는 좋은 용매입니다. 이러한 이유로, 많은 화학 반응은 물에서 일어난다. 이러한 반응은 수성 반응이라고합니다. 수성 반응의 3개의 일반적인 모형은 강수량, 산 기지를, 및 산화 감소입니다.
수성 솔루션의 반응
침전 반응은 불용성 소금 또는 침전을 형성하기 위하여 수성 용액에 있는 이온 화합물 사이 이온의 교환을 관련시킵니다. 산염 염기 반응에서 산은 염기와 반응하고 두 가지는 서로 중화하여 소금과 물을 생성합니다. 산화-감소 반응은 반응하는 종 사이 전자의 전송을 관련시킵니다. 전자를 잃는 반응제는 산화된 것으로 전하며, 전자를 얻는 반응제는 감소된 것으로 전합니다.
수성 반응을 위한 방정식
이온이 관여할 때, 수성 매체에서 일어나는 반응을 나타내는 다양한 방법이 있습니다, 각각 세부 사항의 다른 수준으로. 이를 이해하려면 강수량 반응의 예를 들어 봅시다. 반응은 BaCl2와 AgNO3와같은 이온 화합물의 수성 솔루션 사이입니다. 반응의 제품은 수성 Ba(NO3)2 및 고체 AgCl입니다.

이 균형 잡힌 방정식은 분자 방정식이라고합니다. 분자 방정식은 정량적 계산을 하기 위해 stoichiometric 정보를 제공하고 사용되는 시약과 형성된 제품을 식별하는 데도 도움이 됩니다. 그러나, 분자 방정식은 용액에서 반응 과정의 세부 사항을 제공하지 않는다; 즉, 용액에 존재하는 상이이온 종을 나타내지 않는다.
BaCl2,AgNO 3 및 Ba(NO3)2와 같은 이온 화합물은 수용성입니다. 그들은 그들의 성분 이온으로 해리하여 용해하고, 그들의 이온은 용액에 균질하게 분산됩니다.



AgCl은 불용성 소금이므로 이온으로 해리되지 않으며 고체로 용액에 머물러 있습니다. 위의 요인을 고려할 때, 반응의 보다 현실적인 표현은 다음과 같은 것입니다.
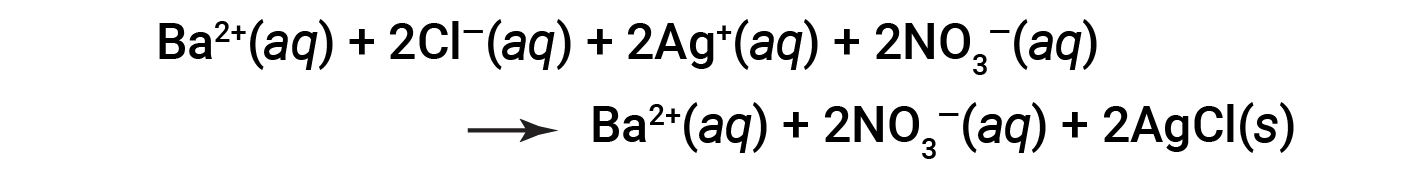
이것은 용해된 모든 이온이 명시적으로 표시되는 완전한 이온 방정식입니다.
이 완전한 이온 방정식은 양쪽에 동일한 형태로 존재하는 두 가지 화학 종을 나타냅니다, Ba2 + (aq)및 NO3− (aq). 이를 관전자 이온이라고 합니다. 이러한 이온의 존재는 전하 중립성을 유지하기 위해 필요합니다. 그들은 화학적으로도 물리적으로 프로세스에 의해 변경되지 않으므로 방정식에서 제거 될 수 있습니다.

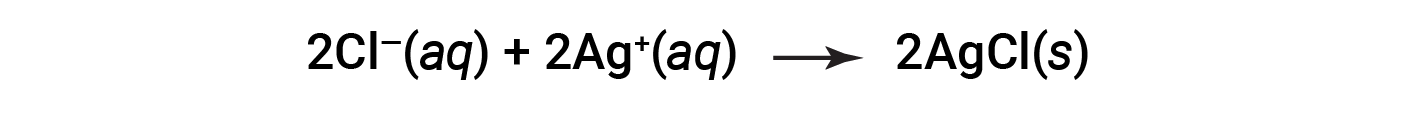
이 방정식은 다음을 제공하기 위해 더 단순화 될 수 있습니다.
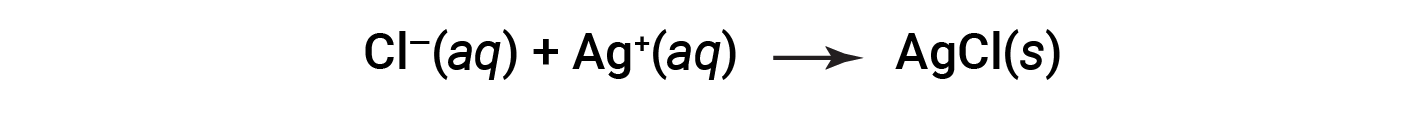
이것은 그물 이온 방정식입니다. 고체 염화물은 이온의 공급원에 관계없이 용해염염화물 및 은 이온으로부터 제조될 수 있음을 나타낸다.
