4.8:
Reazioni chimiche in soluzioni acquose
4.8:
Reazioni chimiche in soluzioni acquose
Le sostanze chimiche interagiscono in molti modi diversi. Alcune reazioni chimiche mostrano modelli comuni di reattività. A causa del gran numero di reazioni chimiche, diventa necessario classificarle in base ai modelli di interazione osservati.
L’acqua è un buon solvente che può sciogliere molte sostanze. Per questo motivo, molte reazioni chimiche si svolgono nell’acqua. Tali reazioni sono chiamate reazioni acquose. I tre tipi più comuni di reazioni acquose sono precipitazione, base acida e riduzione dell’ossidazione.
Reazioni in soluzioni acquose
Una reazione di precipitazione comporta lo scambio di ioni tra composti ionici in soluzione acquosa per formare un sale insolubile o un precipitato. In una reazione acido-base, un acido reagisce con una base, e i due si neutralizzano a vicenda, producendo sale e acqua. Una reazione di ossidazione-riduzione comporta il trasferimento di elettroni tra specie reagenti. Si dice che il reagente che perde elettroni sia ossidato, e si dice che il reagente che guadagna elettroni sia ridotto.
Equazioni per reazioni acquose
Quando gli ioni sono coinvolti, ci sono vari modi per rappresentare le reazioni che si svolgono nei media acquosi, ognuno con un diverso livello di dettaglio. Per capirlo, prendiamo un esempio di reazione di precipitazione. La reazione è tra soluzioni acquose di composti ionici, come BaCl2 e AgNO3. I prodotti della reazione sono acquosi Ba(NO3)2 e AgCl solido.

Questa equazione bilanciata è chiamata equazione molecolare. Le equazioni molecolari forniscono informazioni stechiometriche per effettuare calcoli quantitativi e aiutano anche a identificare i reagenti utilizzati e i prodotti formati. Tuttavia, le equazioni molecolari non forniscono i dettagli del processo di reazione in soluzione; cioè, non indica le diverse specie ioniche presenti in soluzione.
I composti ionici come BaCl2, AgNO3e Ba(NO3)2 sono solubili in acqua. Si dissolvono dissociando nei loro ioni costituenti e i loro ioni sono omogeneamente dispersi in soluzione.



Poiché AgCl è un sale insolubile, non si dissocia in ioni e rimane in soluzione come solido. Considerando i fattori di cui sopra, una rappresentazione più realistica della reazione sarebbe:
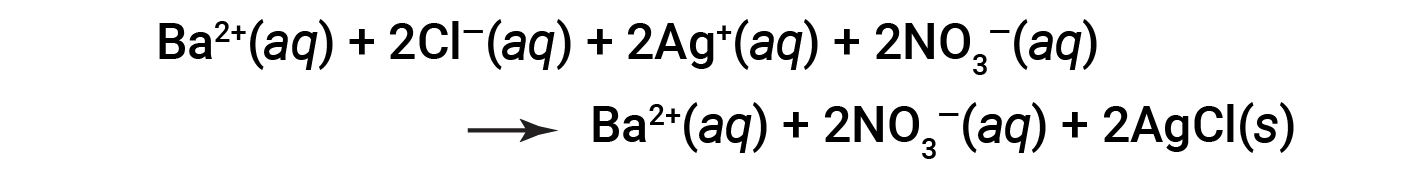
Questa è l’equazione ionica completa in cui tutti gli ioni disciolti sono esplicitamente rappresentati.
Questa equazione ionica completa indica due specie chimiche che sono presenti in forma identica su entrambi i lati, Ba2+ (aq) e NO3− (aq). Questi sono chiamati ioni spettatore. La presenza di questi ioni è necessaria per mantenere la neutralità della carica. Poiché non sono né chimicamente né fisicamente modificati dal processo, possono essere eliminati dall’equazione.

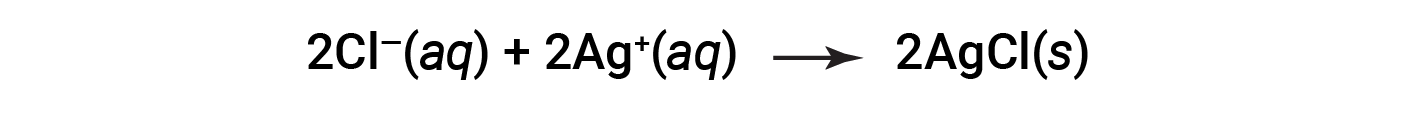
Questa equazione può essere ulteriormente semplificata per dare:
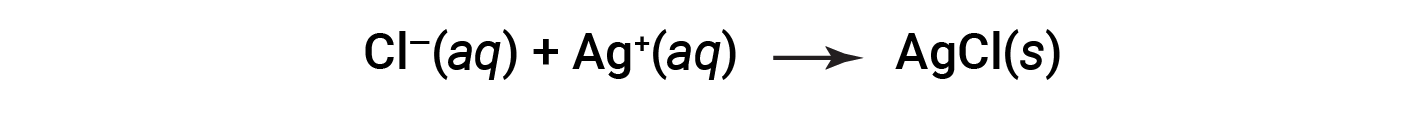
Questa è l’equazione ionica netta. Indica che il cloruro d’argento massiccio può essere prodotto da cloruro disciolto e ioni d’argento, indipendentemente dalla fonte di questi ioni.
Questo testo è adattato da OpenStax Chemistry 2e, Section 4.1: Writing and Balancing Chemical Equations.
