7.6:
방출 스펙트럼
7.6:
방출 스펙트럼
고체, 액체 또는 응축 된 가스가 충분히 가열되면 과도한 에너지중 일부를 빛으로 방출합니다. 이러한 방식으로 생산된 광자는 다양한 에너지를 가지며, 이로 인해 끊어지지 않는 파장이 존재하는 연속 스펙트럼을 생성한다.
연속 스펙트럼과 는 달리, 광도는 스펙트럼 영역 전체에 걸쳐 산재된 매우 좁은 선폭을 갖는 이산 또는 선 스펙트럼으로 도 발생할 수 있습니다. 전류를 사용하여 낮은 부분 압으로 가스를 흥미 진진하게 하거나 가열하면 라인 스펙트럼이 생성됩니다. 형광 전구와 네온 사인은 이런 식으로 작동합니다. 각 요소는 분자와 마찬가지로 자체 특성적인 라인 세트를 표시하지만 스펙트럼은 일반적으로 훨씬 더 복잡합니다.
각 방출 라인은 단일 파장의 빛으로 이루어져 있으며, 이는 가스에서 방출되는 빛이 이산 에너지 집합으로 구성되어 있음을 의미합니다. 예를 들어, 전기 방전이 저압에서 수소 가스를 함유하는 튜브를 통과하면 H2 분자가 별도의 H 원자로 분해되고 블루 핑크 색상이 관찰됩니다. 프리즘을 통해 빛을 전달하면 선 스펙트럼이 생성되어 이 빛이 4개의 가시 파장의 광자로 구성되어 있음을 나타냅니다.
원자와 분자에서 이산 스펙트럼의 기원은 19 세기 후반에 과학자들에게 매우 수수께끼였다. 고전 전자기 이론에 따르면, 만 연속 스펙트럼을 관찰한다. 수소 원자에 대한 다른 이산 선은 UV 및 IR 영역에서 발견되었다. 요하네스 라이드버그는 발머의 작업을 일반화하고 수소의 모든 방출 라인을 예측하는 경험적 공식을 개발, 뿐만 아니라 눈에 보이는 범위에 제한, 어디, n1 과 n2 정수입니다, n1 & n2
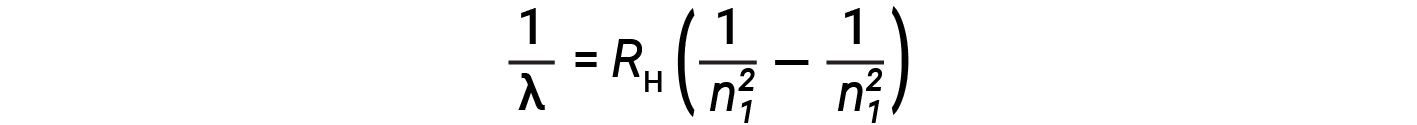
심지어 19 세기 후반에, 분광기는 매우 정확한 과학이었다, 그래서 수소의 파장이 매우 높은 정확도로 측정되었다, 이는 Rydberg 상수가 매우 정확하게 뿐만 아니라 결정 될 수 있음을 암시. Rydberg 공식과 같은 간단한 공식은 당시에 놀라운 것처럼 보였지만, 1913 년 닐스 보어 (Neils Bohr)가 궁극적으로 과학자들은 고전 물리학을 포기하고 현대 양자 역학의 개발을 촉진한 것은 놀라운 것처럼 보였습니다.
