7.7:
O Comprimento de Onda de De Broglie
7.7:
O Comprimento de Onda de De Broglie
No mundo macroscópico, objetos que são suficientemente grandes para serem vistos a olho nu seguem as regras da física clássica. Uma bola de bilhar que se move em uma mesa comporta-se como uma partícula; continuará a viajar em linha reta, a menos que colida com outra bola, ou seja accionada por outra força, como a fricção. A esfera tem uma posição e velocidade bem definidas ou um momentum bem definido, p = mv, que é definido pela massa m e velocidade v em qualquer momento. Este é o comportamento típico de um objeto clássico.
Quando ondas interagem umas com as outras, elas mostram padrões de interferência que não são exibidos por partículas macroscópicas, como a bola de bilhar. No entanto, na década de 1920, tornou-se cada vez mais claro que partes muito pequenas da matéria seguem um conjunto diferente de regras do que grandes objetos. No mundo microscópico, as ondas e as partículas são inseparáveis.
Uma das primeiras pessoas a prestar atenção ao comportamento especial do mundo microscópico foi Louis de Broglie. Ele questionou que se a radiação eletromagnética pode ter carácter semelhante a partículas, poderão os eletrões e outras partículas submicroscópicas apresentar carácter ondulatório? de Broglie ampliou a dualidade onda-partícula da luz que Einstein usou para resolver o paradoxo do efeito fotoelétrico às partículas materiais. Ele previu que uma partícula com massa m e velocidade v (isto é, com momentum linear p) também deveria apresentar o comportamento de uma onda com um valor de comprimento de onda λ, dado por esta expressão na qual h é a constante de Planck:

Isto é chamado de comprimento de onda de de Broglie. Onde Bohr postulou o eletrão como sendo uma partícula orbitando o núcleo em órbitas quantizadas, de Broglie argumentou que a suposição de Bohr de quantização poderia ser explicada se o eletrão fosse em vez disso considerado uma onda circular estacionária. Apenas um número inteiro de comprimentos de onda poderia caber exatamente dentro da órbita.
Se um eletrão for visto como uma onda que se circunda ao redor do núcleo, um número inteiro de comprimentos de onda deve caber na órbita para que este comportamento de onda estacionário seja possível.
Para uma órbita circular de raio r, a circunferência é 2πr, e a condição de de Broglie é:
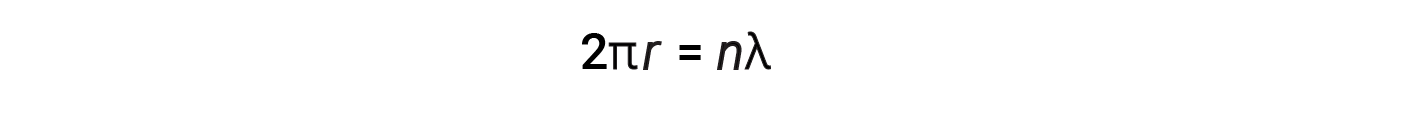
onde n = 1, 2, 3, e assim por diante. Pouco depois de de Broglie ter proposto a natureza ondulatória da matéria, dois cientistas da Bell Laboratories, C. J. Davisson e L. H. Germer, demonstraram experimentalmente que os eletrões poderiam apresentar comportamento ondulatório. Isto foi demonstrado com a finalidade de direcionar um feixe de eletrões para um alvo de níquel cristalino. O espaçamento dos átomos dentro do retículo foi aproximadamente o mesmo que os comprimentos de onda de de Broglie dos eletrões que lhe foram dirigidos, e as camadas atómicas regularmente espaçadas do cristal serviram como ‘fendas’, o que é usado em outras experiências de interferência.
Inicialmente, quando apenas alguns eletrões foram registados, observou-se um comportamento claro semelhante a partículas. À medida que mais eletrões chegaram e foram registados, surgiu um padrão de interferência claro, que é a marca do comportamento ondulatório. Assim, parece que, enquanto que os eletrões são pequenas partículas localizadas, o seu movimento não segue as equações de movimento implícitas pela mecânica clássica. Em vez disso, o seu movimento é governado por uma equação de onda. Assim, a dualidade onda-partícula observada pela primeira vez com fotões é um comportamento fundamental, intrínseco a todas as partículas quânticas.
Este texto é adaptado de Openstax, Chemistry 2e, Section 6.3: Development of Quantum Theory.
