7.13:
As Energias das Orbitais Atômicos
7.13:
As Energias das Orbitais Atômicos
Em um átomo, os eletrões com carga negativa são atraídos para o núcleo com carga positiva. Em um átomo com múltiplos eletrões, são também observadas repulsões electrão-electrão. As forças atrativas e repulsivas dependem da distância entre as partículas, bem como do sinal e magnitude das cargas nas partículas individuais. Quando as cargas nas partículas são opostas, elas atraem-se. Se ambas as partículas tiverem a mesma carga, elas repelem-se uma à outra.
À medida que a magnitude das cargas aumenta, a magnitude da força aumenta. No entanto, quando a separação de cargas é maior, as forças diminuem. Assim, a força de atração entre um eletrão e o seu núcleo é diretamente proporcional à distância entre eles. Se o eletrão estiver mais próximo do núcleo, ele está ligado mais fortemente ao núcleo; portanto, os eletrões nas diferentes camadas (a distâncias diferentes) têm energias diferentes.
Para átomos com múltiplos níveis de energia, os eletrões interiores protegem parcialmente os eletrões exteriores da atração do núcleo, devido a repulsões de eletrão-eletrão. Os eletrões no núcleo protegem os eletrões nas camadas exteriores, enquanto que os eletrões na mesma camada de valência não bloqueiam a atração nuclear experienciada uns pelos outros de forma tão eficiente. Isto pode ser explicado com o conceito de carga nuclear efetiva, Zeff. Esta é a força exercida sobre um eletrão específico pelo núcleo, tendo em conta quaisquer repulsões de eletrão-eletrão. Para o hidrogénio, existe apenas um eletrão, e por isso a carga nuclear (Z) e a carga nuclear efetiva (Zeff) são iguais. Para todos os outros átomos, os eletrões interiores protegem parcialmente os eletrões exteriores da atração do núcleo e, por conseguinte:

A penetração orbital descreve a capacidade de um eletrão estar mais próximo do núcleo. Os eletrões na orbital s podem aproximar-se do núcleo e ter uma capacidade mais penetrante. A densidade de probabilidade para uma orbital s esférica não é zero no núcleo. Diferentes subcamadas têm diferentes orientações espaciais. Devido à orbital em forma de haltere, o eletrão p penetra muito menos. A sua função de onda tem um nó que passa pelo núcleo, onde a probabilidade de encontrar o eletrão é zero. Assim, um eletrão de orbital s está ligado mais fortemente ao núcleo e tem energia mais baixa do que o eletrão p. Um eletrão d tem uma penetração ainda mais baixa e uma energia mais elevada do que um eletrão de orbital p.
Para várias camadas e subcamadas, a tendência de poder de penetração de um eletrão pode ser representada da seguinte forma
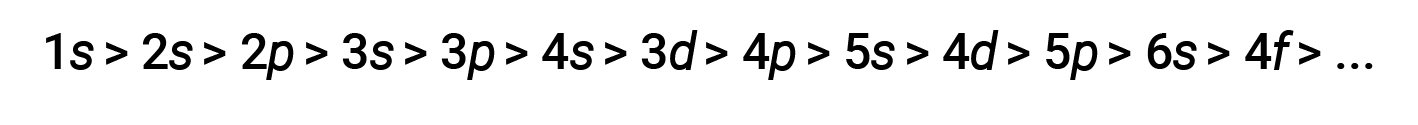
O efeito de proteção e penetração é grande, e um eletrão 4s pode ter energia mais baixa do que um eletrão 3d.
Este texto é adaptado de Openstax, Chemistry 2e, Section 6.4: Electronic Structure of Atoms (Electron Configurations).
