7.13:
Le energie degli orbitali atomici
7.13:
Le energie degli orbitali atomici
In un atomo, gli elettroni caricati negativamente sono attratti dal nucleo caricato positivamente. In un atomo multielettronico, si osservano anche repulsioni elettrone-elettrone. Le forze attrattive e repulsive dipendono dalla distanza tra le particelle, così come dal segno e dalla grandezza delle cariche sulle singole particelle. Quando le cariche sulle particelle sono opposte, si attraggono a vicenda. Se entrambe le particelle hanno la stessa carica, si respingono a vicenda.
Con l’aumentare dell’entità delle cariche, aumenta l’entità della forza. Tuttavia, quando la separazione delle cariche è maggiore, le forze diminuiscono. Quindi, la forza di attrazione tra un elettrone e il suo nucleo è direttamente proporzionale alla distanza tra loro. Se l’elettrone è più vicino al nucleo, è legato più strettamente al nucleo; quindi, gli elettroni nei diversi gusci (a distanze diverse) hanno energie diverse.
Per gli atomi con più livelli di energia, gli elettroni interni proteggono parzialmente gli elettroni esterni dall’attrazione del nucleo, a causa delle repulsioni elettrone-elettrone. Gli elettroni del nucleo proteggono gli elettroni nei gusci esterni, mentre gli elettroni nello stesso guscio di valenza non bloccano l’attrazione nucleare sperimentata l’uno dall’altro in modo così efficiente. Ciò può essere spiegato con il concetto di carica nucleare effettiva, Zeff. Questa è l’attrazione esercitata su uno specifico elettrone dal nucleo, tenendo conto di eventuali repulsioni elettrone-elettrone. Per l’idrogeno, c’è un solo elettrone, e quindi la carica nucleare (Z) e la carica nucleare effettiva (Zeff) sono uguali. Per tutti gli altri atomi, gli elettroni interni proteggono parzialmente gli elettroni esterni dall’attrazione del nucleo, e quindi:

La penetrazione orbitale descrive la capacità di un elettrone di essere più vicino al nucleo. Gli elettroni nell’orbitale spossono avvicinarsi al nucleo e avere una capacità più penetrante. La densità di probabilità per una sfericas-orbitale è diversa da zero nel nucleo. Diverse sottoshell hanno orientamenti spaziali diversi. A causa dell’orbitale a forma di manubrio, l’elettrone ppenetra molto meno. La sua funzione d’onda ha un nodo che passa attraverso il nucleo, dove la probabilità di trovare l’elettrone è zero. Quindi, un elettrone orbitale s è legato più strettamente al nucleo e ha un’energia inferiore rispetto all’elettrone p. Un d-elettrone ha una penetrazione ancora più bassa e un’energia superiore rispetto a un elettrone orbitale p.
Per vari gusci e sottoshell, la tendenza del potere penetrante di un elettrone può essere descritta come segue:
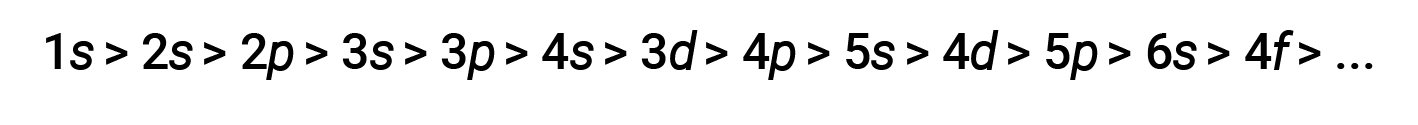
L’effetto della schermatura e della penetrazione è grande, e un elettrone 4s può avere un’energia inferiore rispetto a un elettrone3d.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 6.4: Struttura elettronica degli atomi (configurazioni elettroniche).
