10.1:
전자쌍 반발 이론과 기본 모양
10.1:
전자쌍 반발 이론과 기본 모양
VSEPR 이론 개요
Valence 쉘 전자 쌍 반발 이론 (VSEPR 이론)은 루이스 구조의 결합 및 고독한 전자 쌍의 수의 검사에서 분자의 중앙 원자 주위에 대략적인 결합 각도를 포함하여 분자 구조를 예측 할 수 있습니다. VSEPR 모델은 중앙 원자의 원자 껍질에 있는 전자 쌍이 그들 사이의 거리를 최대화하여 이 전자 쌍 사이 반발을 최소화하는 배열을 채택할 것이라는 점을 가정합니다. 중앙 원자의 원자 껍질에 있는 전자는 결합된 원자 사이, 또는 외로운 쌍 사이에서 주로 위치한 전자의 결합 쌍 중 하나. 이러한 전자의 정전기 반발은 고전자 밀도의 다양한 영역이 가능한 한 서로 멀리 위치를 가정할 때 감소된다.
VSEPR 이론은 각 중앙 원자 주위에 전자 쌍의 배열을 예측하고, 일반적으로, 분자에 있는 원자의 정확한 배열을 예측합니다. 그러나 이론은 전자 쌍 반발만 고려한다는 것을 이해해야 합니다. 핵-핵 반발 및 핵전자 어트랙션과 같은 다른 상호 작용도 원자가 특정 분자 구조에서 채택하는 최종 배열에 관여합니다.
VSEPR 이론의 적용
VSEPR 이론은 분자의 구조를 예측하는 데 사용될 수 있다. 예를 들어, 기체 CO2 분자의 구조를 예측해 봅시다. CO2 (그림 1)의 루이스 구조는 중앙 탄소 원자 주위에 두 개의 전자 그룹을 보여줍니다. 중앙 원자에 두 개의 접합 단과 고독한 전자 쌍이 있는 경우, 유대는 가능한 한 멀리 떨어져 있으며, 중앙 원자의 반대편에 있을 때 이 영역 간의 정전기 반발은 최소한으로 감소된다. 결합 각도는 180°입니다.
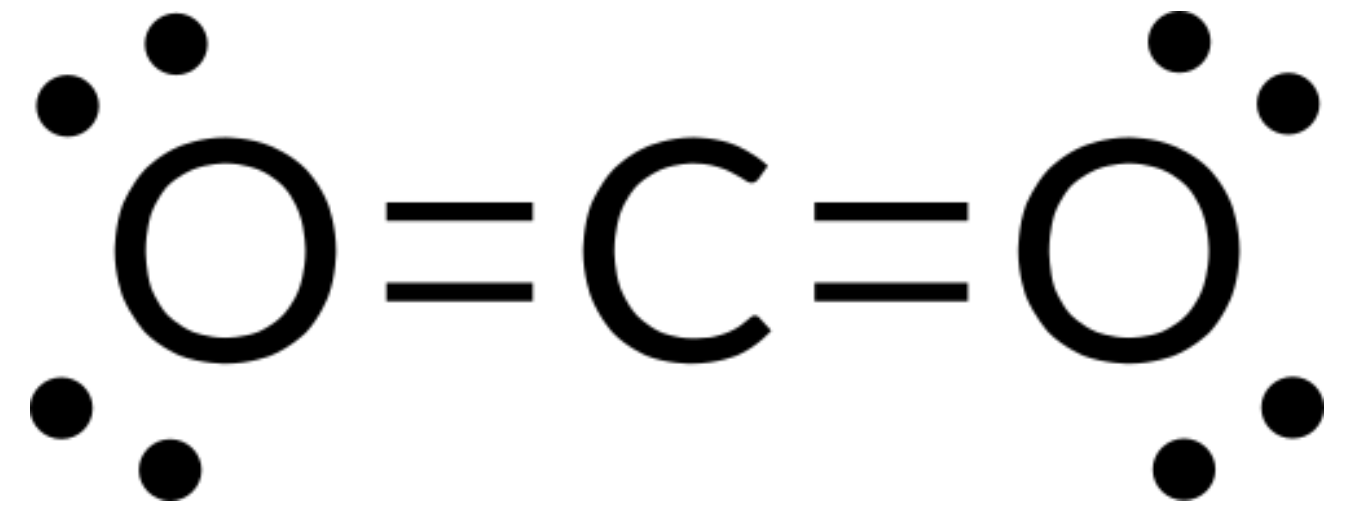
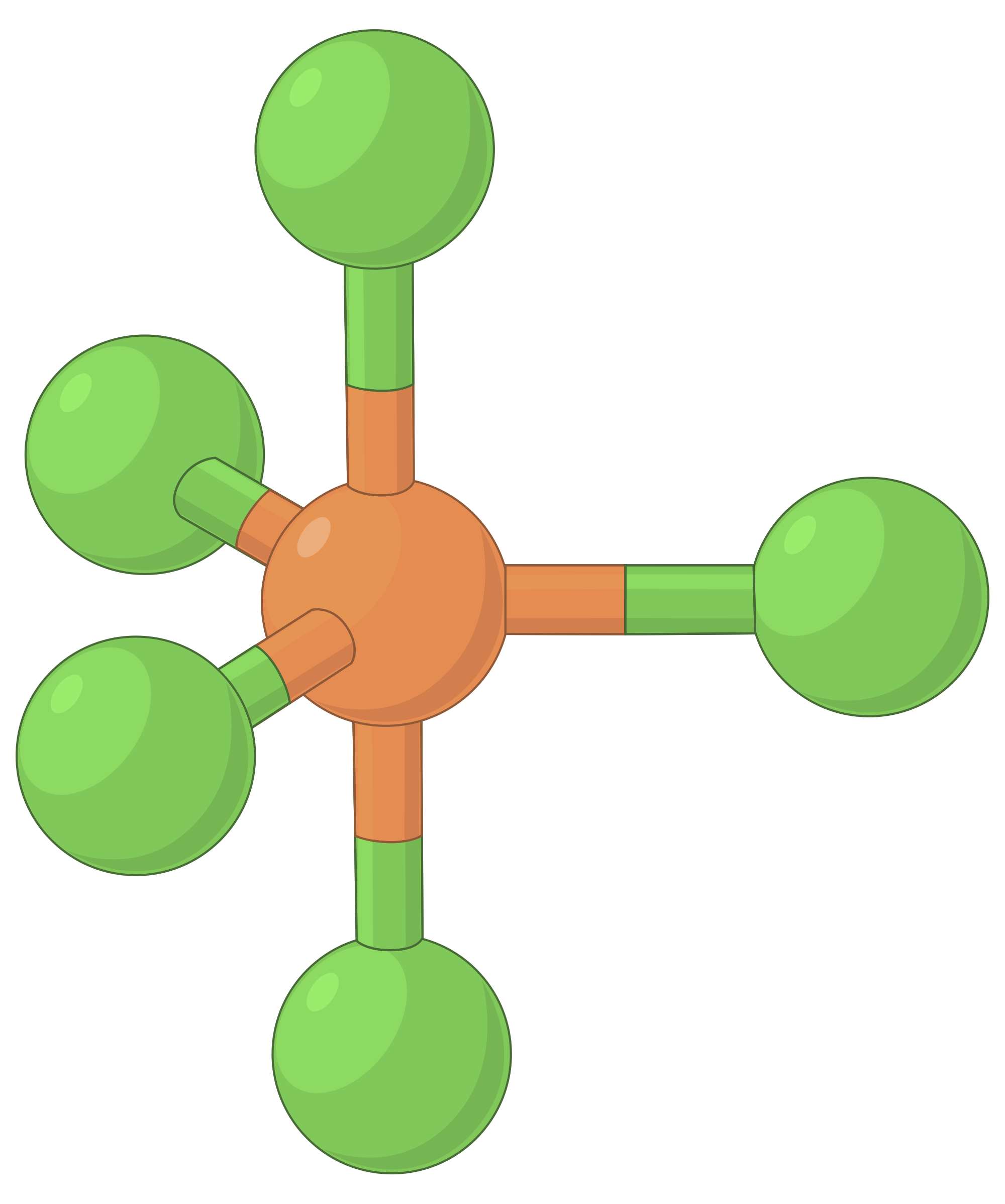
아래 표는 높은 전자 밀도 (채권 및 / 또는 외로운 쌍)의 영역 간의 반발을 최소화 전자 쌍 기하학을 보여줍니다. 분자에서 중앙 원자 주위의 전자 밀도의 두 영역은 선형 형상을 형성한다; 세 영역은 삼각형 평면 형상을 형성한다. 4개의 영역은 테트라헤드랄 형상을 형성한다. 5개의 영역은 삼각 상피라미드 형상을 형성하고, 6개의 영역은 옥타히드랄 형상을 형성한다.
| BeF2 | BF3 | CH4 | PCl5 | SF6 | |
| 전자 영역 수 | 2 | 3 | 4 | 5 | 6 |
| 전자 영역 형상 | 선형; 180° 각도 | 삼각 평면; 모든 각도 120° | 테트라헤드랄; 모든 각도 109.5° | 삼각 바이피라미드, 각도 90° 또는 120°. | 옥타히드랄; 모든 각도90° 또는 180°. |
| 공간 배치 | 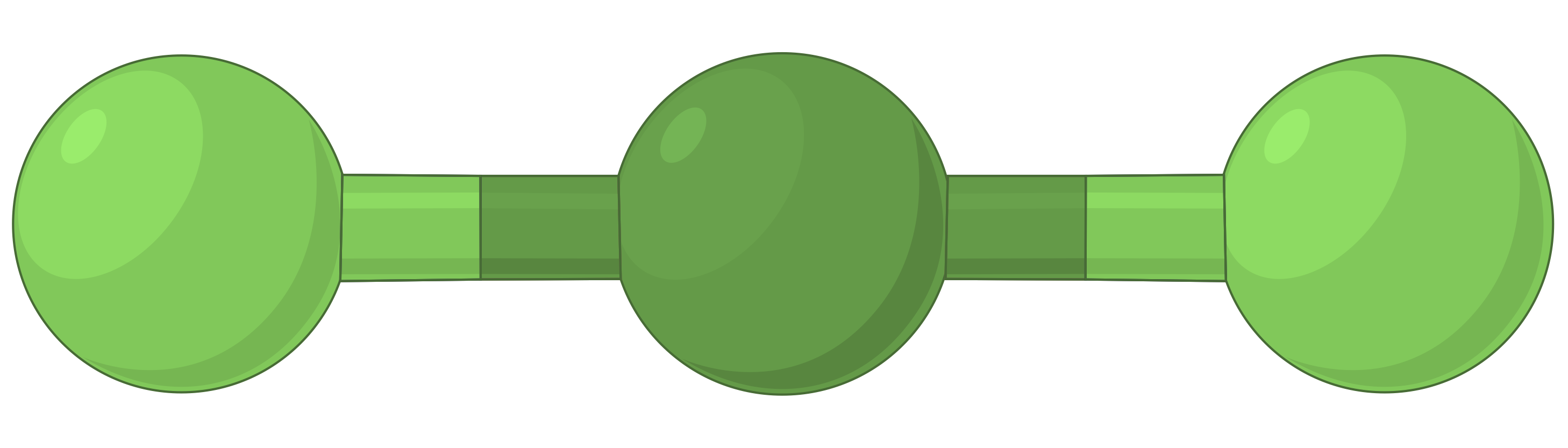 |
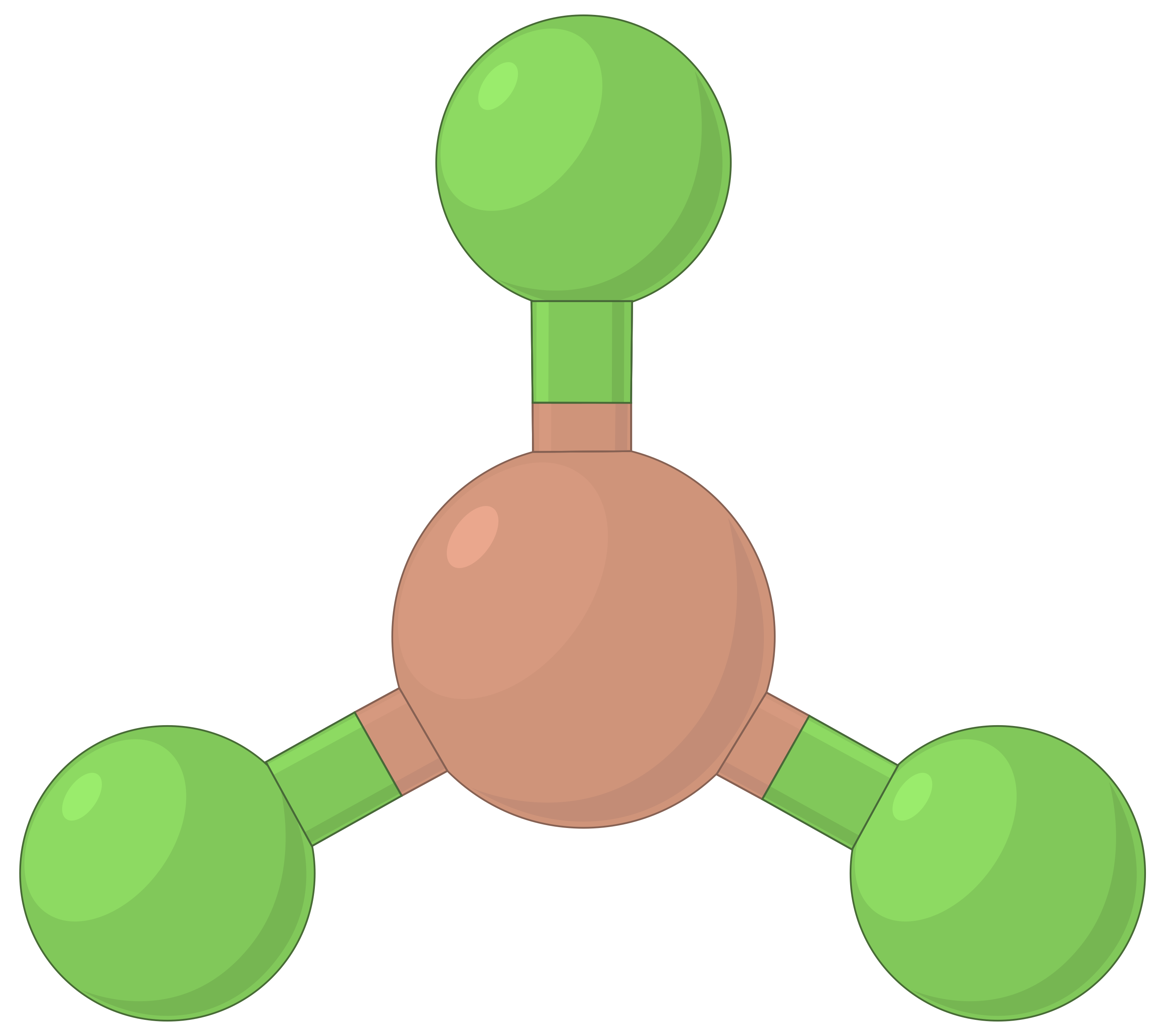 |
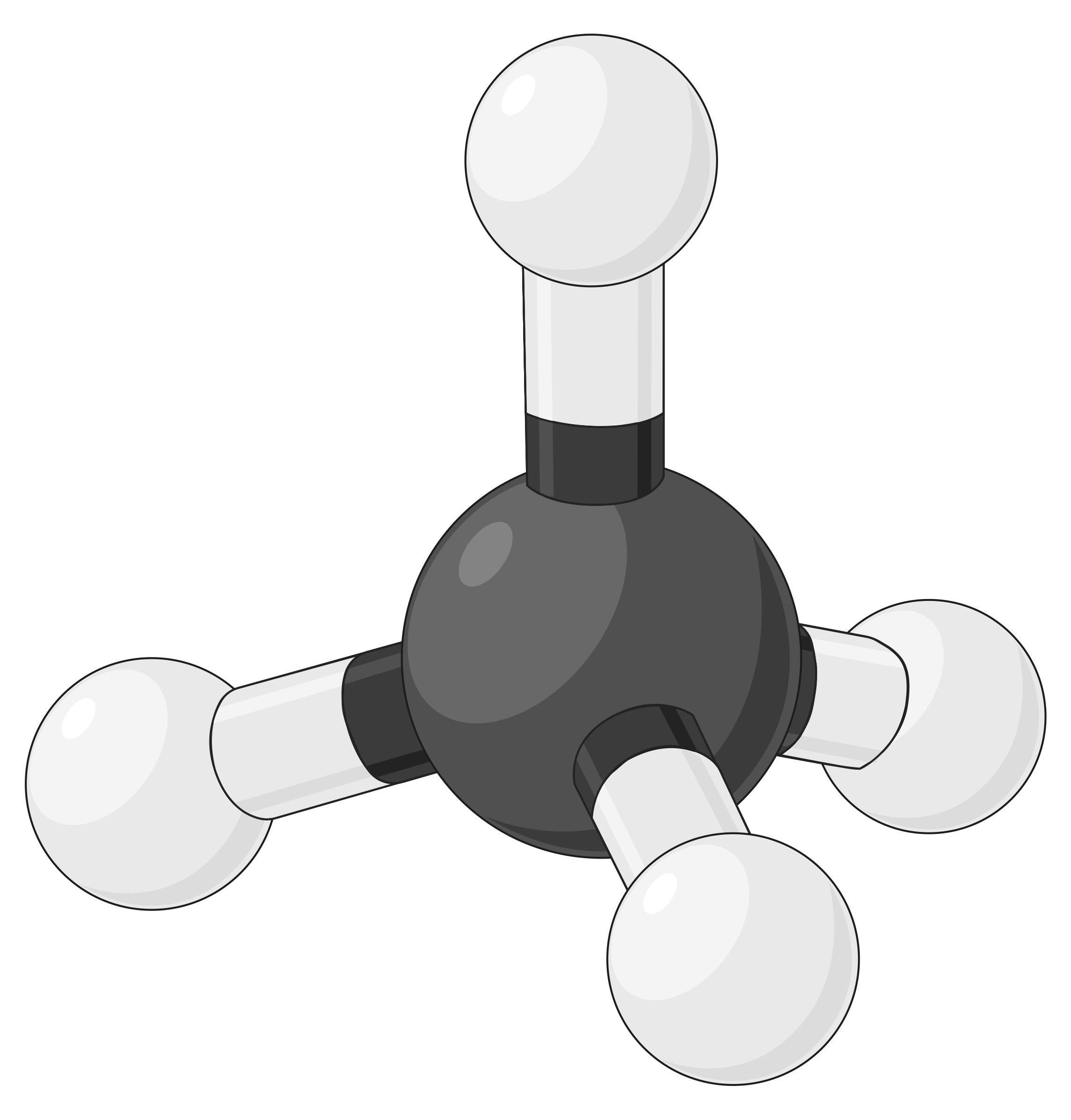 |
 |
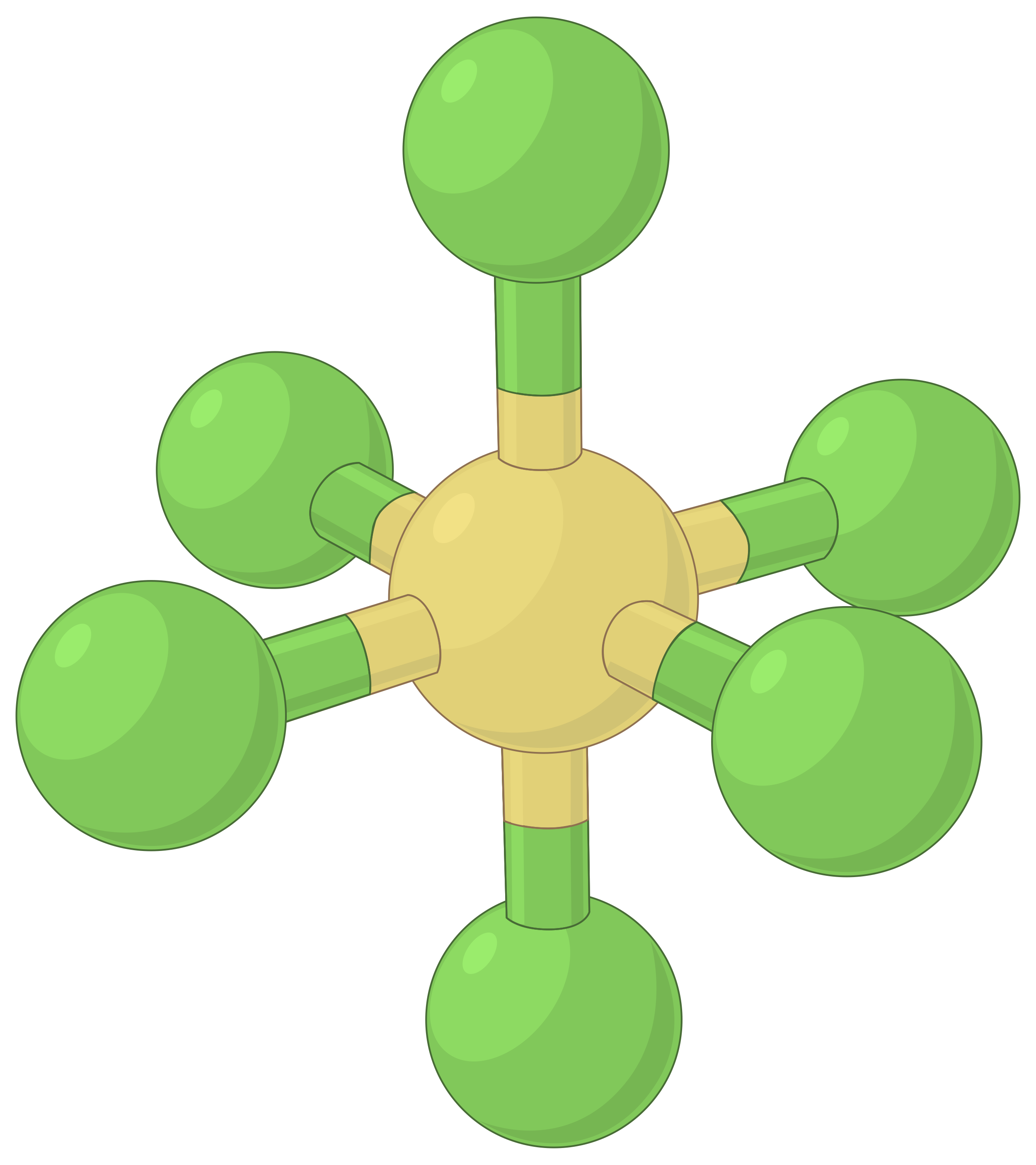 |
표 1. VSEPR 이론에 의해 예측된 기본 전자 쌍 기하학은 전자 밀도(결합 또는 외로운 쌍)의 모든 영역 주위의 공간을 최대화합니다.
이 텍스트는 Openstax, 화학 2e, 섹션 7.6: 분자 구조 및 극성에서적용되었습니다.
