10.1:
Теория VSEPR и основные формы
10.1:
Теория VSEPR и основные формы
Обзор теории VSEPR
Теория отталкивания электронных пар валентной оболочки (ОЭПВО, или теория VSEPR по-английски) позволяет нам предсказать молекулярную структуру, включая приблизительные углы связи вокруг центрального атома, молекулы от исследования количества связей и одиночных электронных пар в его структуре Льюиса. Модель VSEPR предполагает, что пары электронов в оболочке валентности центрального атома примут схему, которая минимизирует отталкивания между этими парами электронов, максимизируя расстояние между ними. Электроны в валентной оболочке центрального атома образуют либо связанные пары электронов, расположенные преимущественно между связанными атомами, либо неподелённые пары. Электростатическое отталкивание этих электронов уменьшается, когда различные области высокой электронной плотности принимают положения как можно дальше друг от друга.
Теория VSEPR предсказывает расположение электронных пар вокруг каждого центрального атома и, как правило, правильное расположение атомов в молекуле. Однако мы должны понимать, что теория рассматривает только отталкивания электронных пар. Другие взаимодействия, такие как атомные отталкивания и аттракционы атомов, также участвуют в окончательном устройстве, которое атомы принимают в определенной молекулярной структуре.
Применение теории VSEPR
Для прогнозирования структуры молекул можно использовать теорию VSEPR. Например, давайте спрогнозируем структуру молекулы газообразного CO2. Структура Льюиса CO2 (рис. 1) показывает только две группы электронов вокруг центрального атома углерода. При наличии двух связных групп и отсутствии неподелённых пар электронов на центральном атоме связи находятся как можно дальше друг от друга, а электростатическое отталкивание между этими областями высокой электронной плотности уменьшается до минимума, когда они находятся на противоположных сторонах центрального атома. Угол связи составляет 180°.
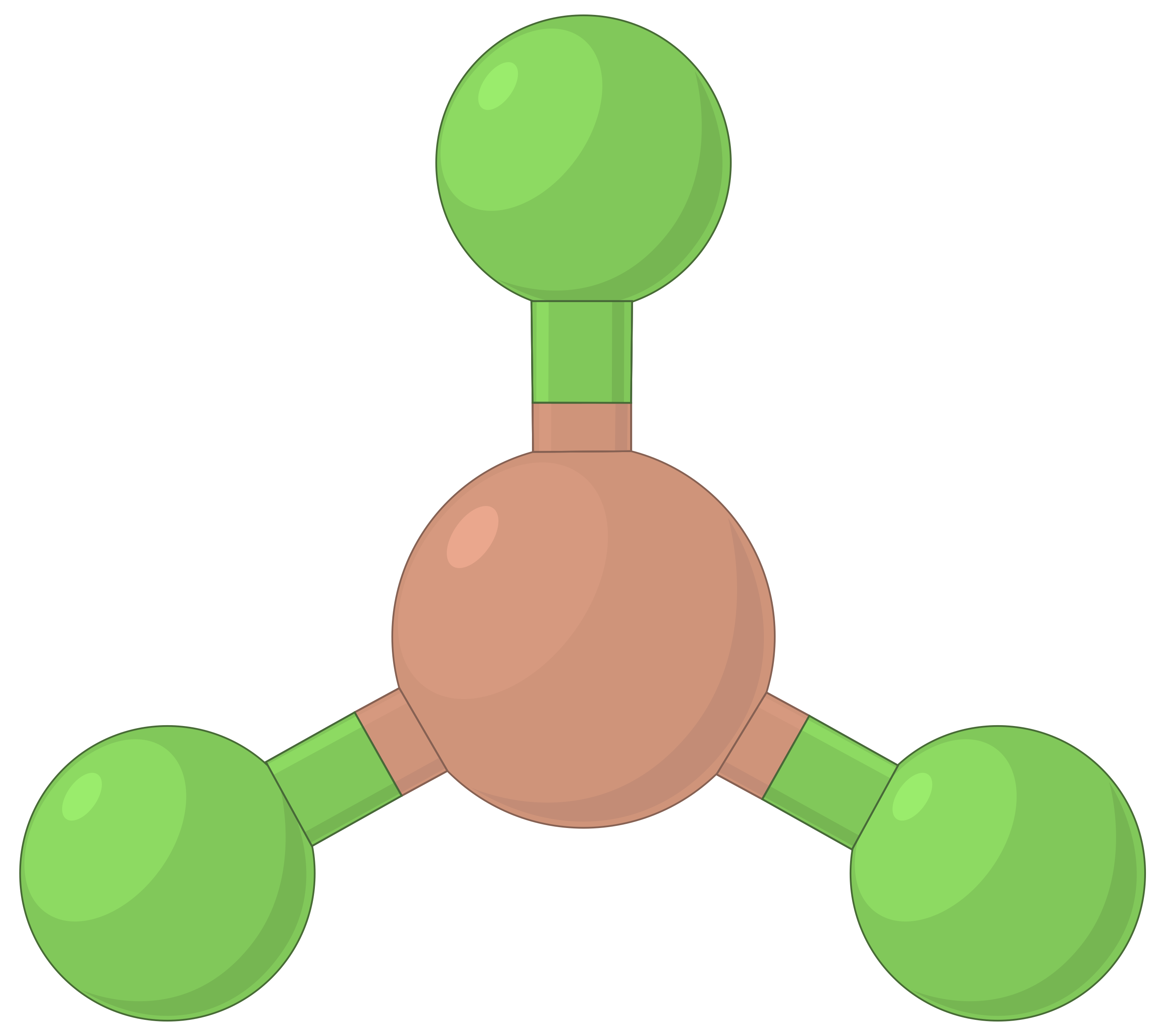
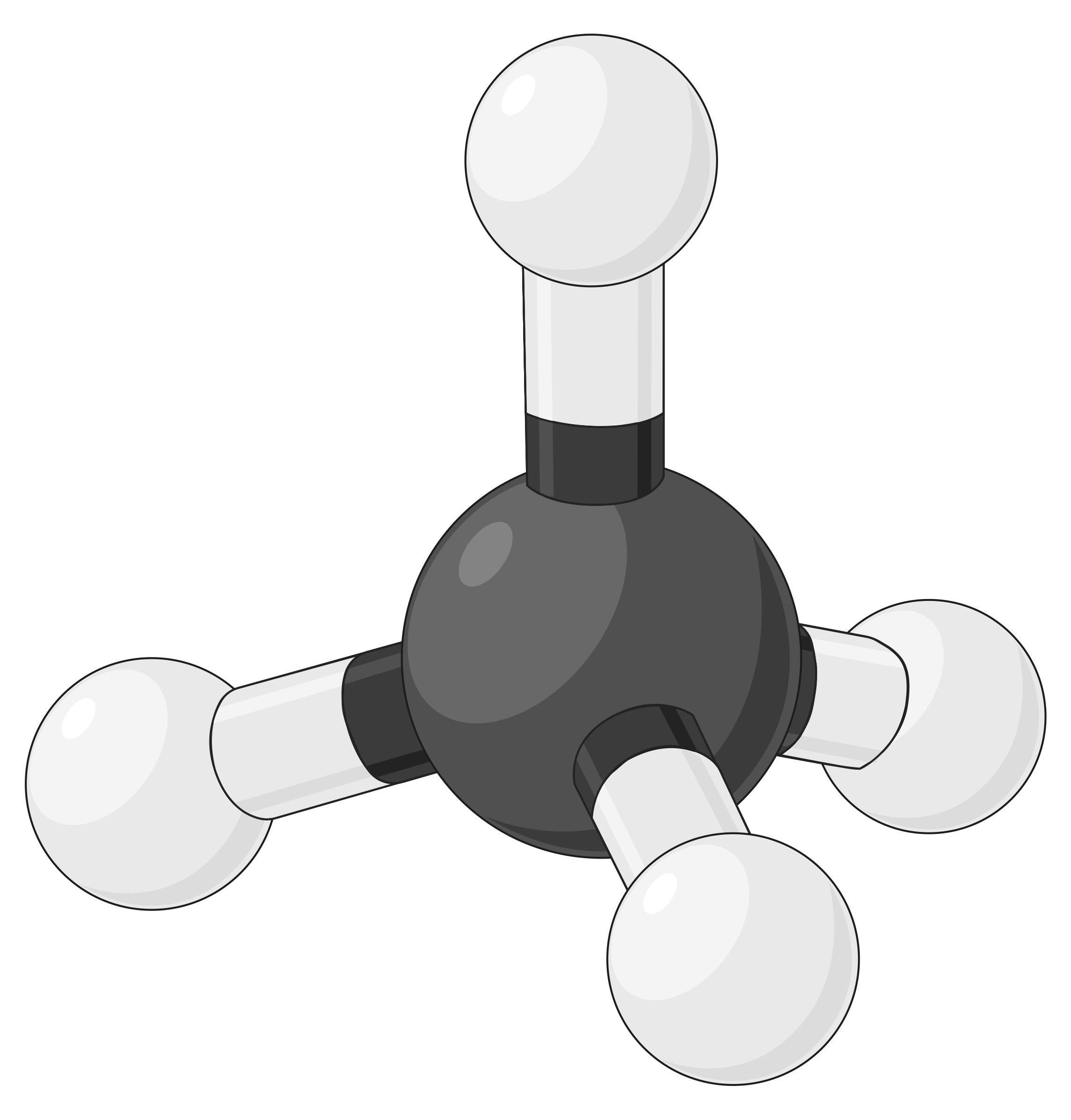
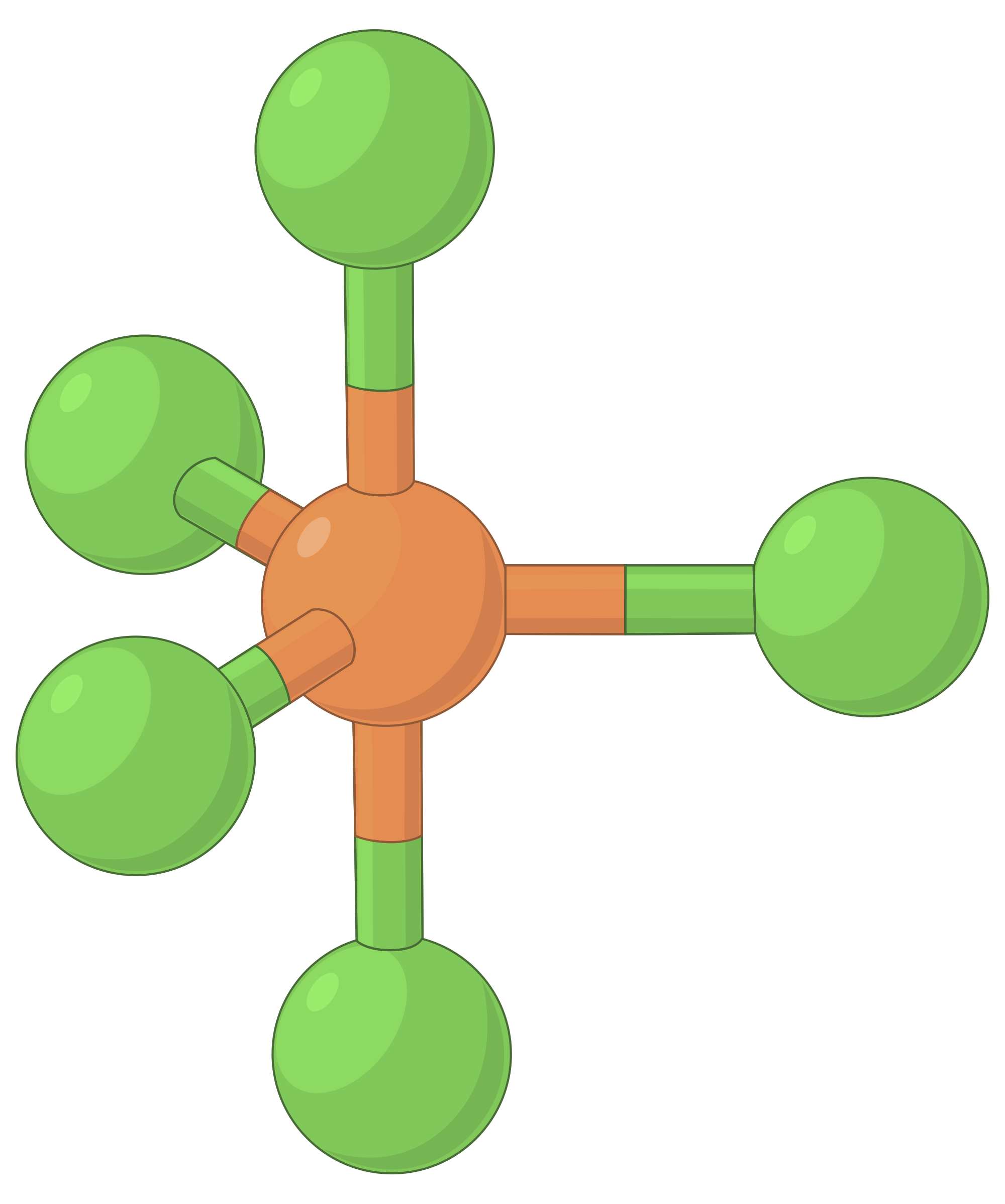
В таблице ниже представлены геометрии пар электронов, которые минимизируют отталкивания между областями высокой электронной плотности (связи и/или одиночные пары). Две области электронной плотности вокруг центрального атома в молекуле образуют линейную геометрию; три области образуют тригональную плоскую геометрию; четыре области образуют тетраэдрическую геометрию; пять областей образуют тригональную бипирамидальную геометрию, а шесть областей образуют октаэдральную геометрию.
| BeF2 | BF3 | CH4 | PCL5 | SF6 | |
| Количество областей электронов | 2 | 3 | 4 | 5 | 6 |
| Геометрия области электронов | Линейный; угол 180° | Трехугольный плоский; все углы 120° | Тетраэдр; все углы 109.5° | Тригональная бипирамидальная, углы 90° или 120°. | Октаэдрический; все углы 90° или 180°. |
| Пространственное расположение | 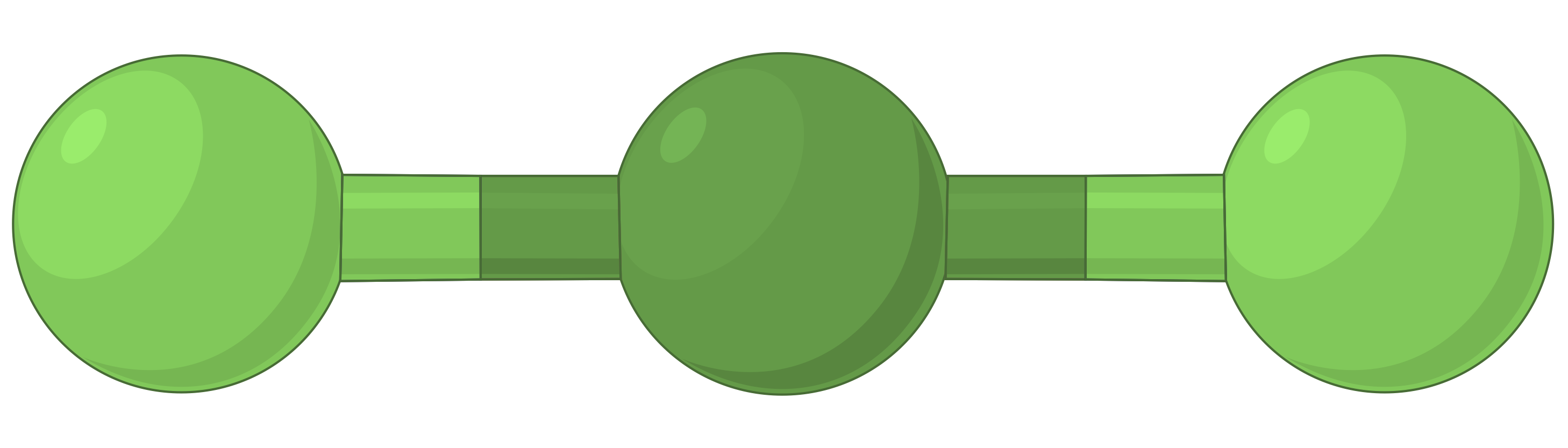 |
 |
 |
 |
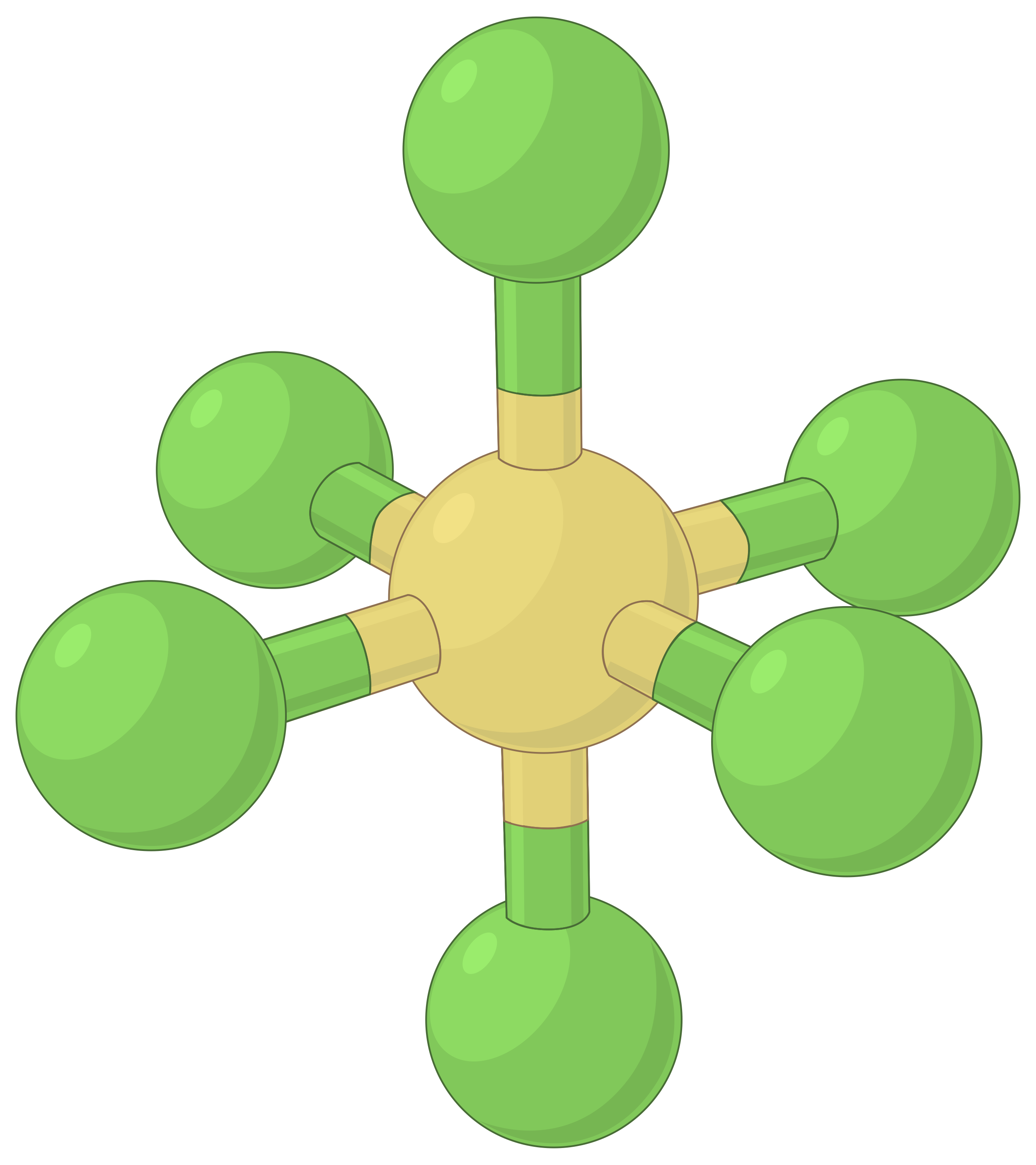 |
Таблица 1. Основные геометрии пар электронов, предсказанные теорией VSEPR, максимально увеличивают пространство вокруг любой области электронной плотности (связей или одиночных пар).
Этот текст был адаптирован из Openstax, Химия 2е изд., раздел 7.6: Молекулярная структура и полярность.
