11.11:
Changement d'état : sublimation et condensation solide
11.11:
Changement d'état : sublimation et condensation solide
Certains solides peuvent passer directement à l’état gazeux, en contournant l’état liquide, par le biais d’un processus connu sous le nom de sublimation. À la température ambiante et à la pression standard, un morceau de glace carbonique (CO2 solide) se sublime, semblant disparaître progressivement sans jamais former de liquide. La neige et la glace se subliment à des températures inférieures au point de fusion de l’eau, un processus lent qui peut être accéléré par les vents et les pressions atmosphériques réduites à des altitudes élevées. Lorsque l’iode solide est réchauffé, l’iode solide se sublime et une vapeur d’un violet vif se forme. L’inverse de la sublimation est appelé dépôt, un processus dans lequel les substances gazeuses se condensent directement à l’état solide, en contournant l’état liquide. La formation de givre est un exemple de dépôt.
Tout comme la vaporisation, le processus de sublimation nécessite un apport d’énergie pour surmonter les attractions intermoléculaires. La sublimation est donc une transition de phase endothermique. L’enthalpie de sublimation, ΔHsub, est l’énergie nécessaire pour convertir une mole d’une substance de l’état solide à l’état gazeux. Par exemple, la sublimation du dioxyde de carbone est représentée par :

De même, la variation d’enthalpie pour le processus inverse du dépôt est d’une valeur égale mais de signe opposé à celle de la sublimation. Comme le dépôt implique la formation de forces intermoléculaires, il s’agit d’une transition de phase exothermique.

Considérons la mesure dans laquelle les attractions intermoléculaires doivent être surmontées pour réaliser une transition de phase donnée. Transformer un solide en liquide exige que ces attractions ne soient que partiellement surmontées ; la transition vers l’état gazeux exige qu’elles soient complètement surmontées. Par conséquent, l’enthalpie de fusion d’une substance est inférieure à son enthalpie de vaporisation. Cette même logique peut être utilisée pour déduire une relation approximative entre les enthalpies de tous les changements de phase pour une substance donnée. Bien que cette description ne soit pas entièrement exacte, la sublimation peut aisément être modélisée comme un processus séquentiel de fusion en deux étapes suivi de la vaporisation afin d’appliquer la loi de Hess. De cette manière, l’enthalpie de sublimation d’une substance peut être estimée comme la somme de ses enthalpies de fusion et de vaporisation.
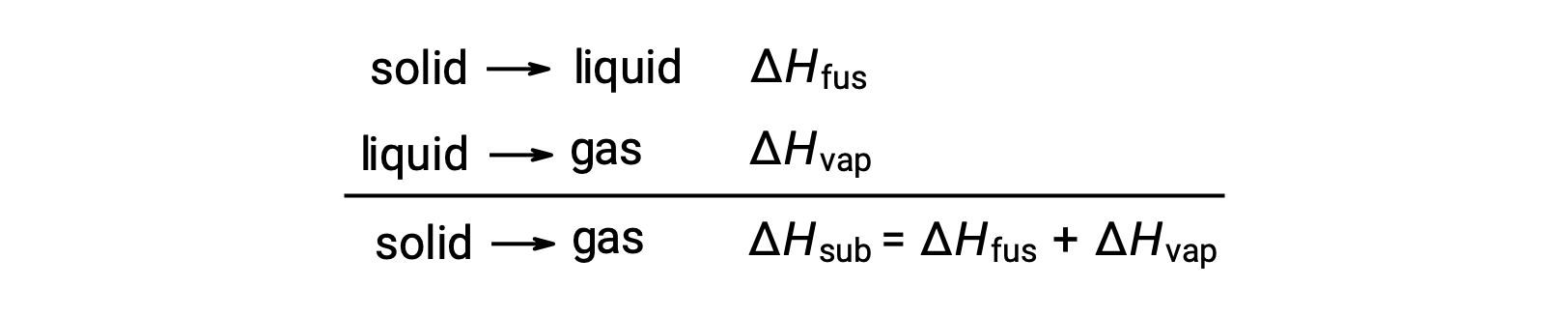
Ce texte est adapté de Openstax, Chimie 2e, Section 10.3 : Transitions de phases.
