11.11:
Hal Değişmleri: Süblimleşme ve Kırağılaşma
11.11:
Hal Değişmleri: Süblimleşme ve Kırağılaşma
Bazı katılar, süblimasyon olarak bilinen bir işlemle sıvı durumu atlayarak doğrudan gaz haline geçebilir. Oda sıcaklığında ve standart basınçta, bir parça kuru buz (katı CO2) süblimleşir ve hiç sıvı oluşturmadan kademeli olarak kaybolur gibi görünür. Suyun erime noktasının altındaki sıcaklıklarda kar ve buz süblimleşir, rüzgarlar ve yüksek irtifalarda düşük atmosferik basınçlar tarafından hızlandırılabilen yavaş bir süreçtir. Katı iyot ısıtıldığında, katı süblimleşir ve canlı mor bir buhar oluşur. Süblimleşmenin tersine, gaz halindeki maddelerin sıvı halden geçerek doğrudan katı halde yoğunlaştığı bir süreç olan biriktirme denir. Don oluşumu, çökelmeye bir örnektir.
Buharlaşma gibi, süblimasyon süreci de moleküller arası çekimlerin üstesinden gelmek için bir enerji girdisine ihtiyaç duyar. Süblimasyon, bu nedenle, bir endotermik faz geçişidir. Süblimleşme entalpisi, ΔHsub, bir mol maddenin katı halden gaz haline dönüştürülmesi için gereken enerjidir. Örneğin, karbondioksitin süblimleşmesi şu şekilde temsil edilir:

Likewise, the enthalpy change for the reverse process of deposition is equal in magnitude but opposite in sign to that for sublimation. Because deposition involves the formation of intermolecular forces, it is an exothermic phase transition.
Benzer şekilde, ters çökelme süreci için entalpi değişimi büyüklük olarak eşittir, ancak işaret olarak süblimasyon için olanın tam tersidir. Biriktirme, moleküller arası kuvvetlerin oluşumunu içerdiğinden, ekzotermik bir faz geçişidir.

Belirli bir faz geçişine ulaşmak için moleküller arası çekimlerin ne ölçüde üstesinden gelinmesi gerektiğini düşünün. Bir katıyı sıvıya dönüştürmek, bu çekimlerin yalnızca kısmen üstesinden gelinmesini gerektirir; gaz haline geçiş, bunların tamamen üstesinden gelinmesini gerektirir. Sonuç olarak, bir maddenin füzyon entalpisi, buharlaşma entalpisinden daha azdır. Bu aynı mantık, belirli bir madde için tüm faz değişikliklerinin entalpileri arasında yaklaşık bir ilişki türetmek için kullanılabilir. Tamamen doğru bir açıklama olmasa da süblimasyon, Hess Yasasını uygulamak için ardışık iki aşamalı eritme işlemi ve ardından buharlaştırma olarak uygun şekilde modellenebilir. Bu şekilde bakıldığında, bir maddenin süblimasyon entalpisi, füzyon ve buharlaşma entalpilerinin toplamı olarak tahmin edilebilir.
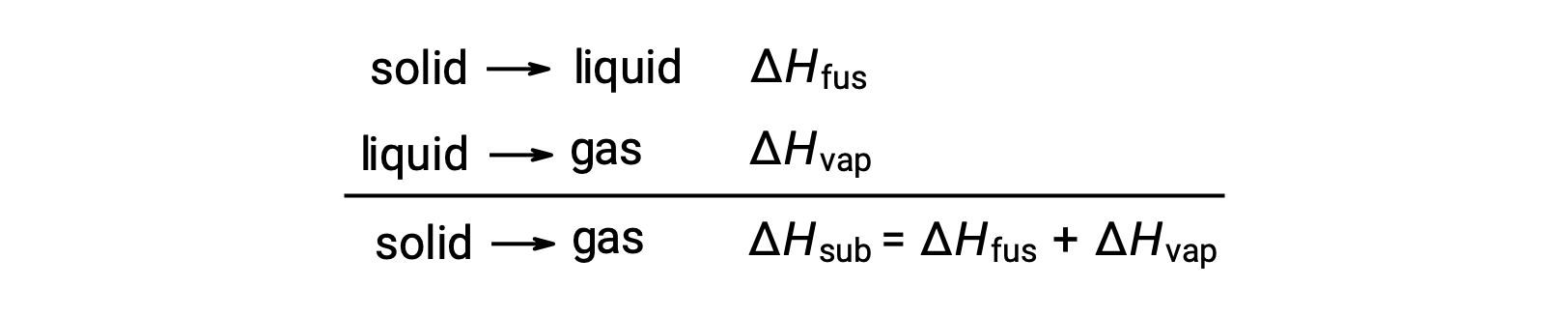
Bu metin bu kaynaktan uyarlanmıştır Openstax, Chemistry 2e, Section 10.3: Phase Transitions.
