12.7:
التعبير عن تركيز المحلول
12.7:
التعبير عن تركيز المحلول
المذاب هو أحد مكونات المحلول الذي يوجد عادةً بتركيز أقل بكثير من المذيب. وغالباً ما يتم وصف تركيزات المذاب بعبارات نوعية مثل مخفف (بتركيز منخفض نسبياً) ومركّز (بتركيز مرتفع نسبياً) .
يمكن تقييم التركيزات كميًا باستخدام مجموعة متنوعة من وحدات القياس، كل منها مناسب لتطبيقات معينة. المولارية (M) هي وحدة تركيز مفيدة للعديد من التطبيقات في الكيمياء. تُعرَّف المولارية بأنها كمية المذاب في عدد المولات مقسومة على حجم المحلول باللترات:

نظراً لأن أحجام المحلول تختلف باختلاف درجة الحرارة، فإن التركيزات المولية ستختلف أيضاً. عند التعبير عن المولارية، فإن تركيز المحلول بأعداد متطابقة من الأنواع المذابة والمذيبات سيكون مختلفاً عند درجات حرارة مختلفة بسبب تقلص/تمدد المحلول. الأكثر ملاءمة للحسابات التي تنطوي على العديد من الخصائص التجميعية هي وحدات التركيز القائمة على المول والتي لا تعتمد قيمها على درجة الحرارة. اثنتان من هذه الوحدات هما الكِسر المولي (الذي تم تقديمه في الفصل السابق المتعلق بالغازات) والمولالية.
الكِسر المولي، χA لمكون ما هو نسبة الكمية المولية إلى العدد الإجمالي للمولات لجميع مكونات المحلول :
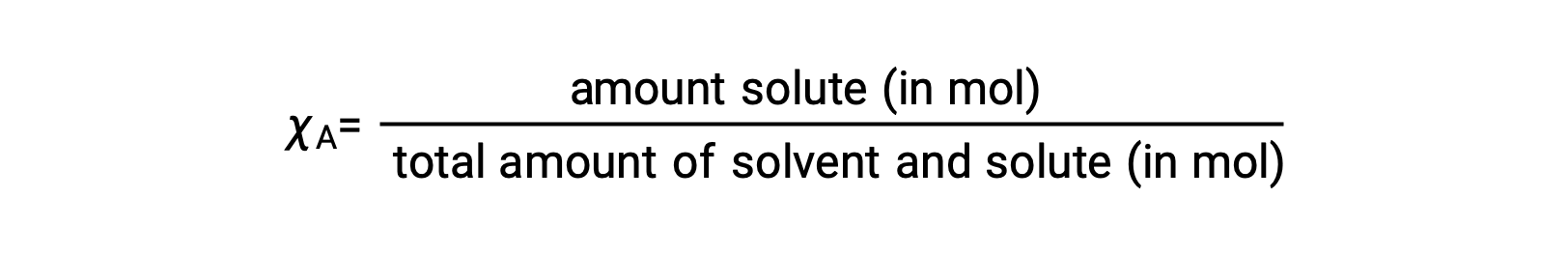
وفقاً لهذا التعريف، فإن مجموع الكسور المولية لجميع مكونات المحلول (المذيب وجميع المواد المذابة) يساوي واحداً.
المولالية هي وحدة تركيز يتم تعريفها على أنها نسبة عدد مولات المذاب إلى كتلة المذيب بالكيلوغرام:
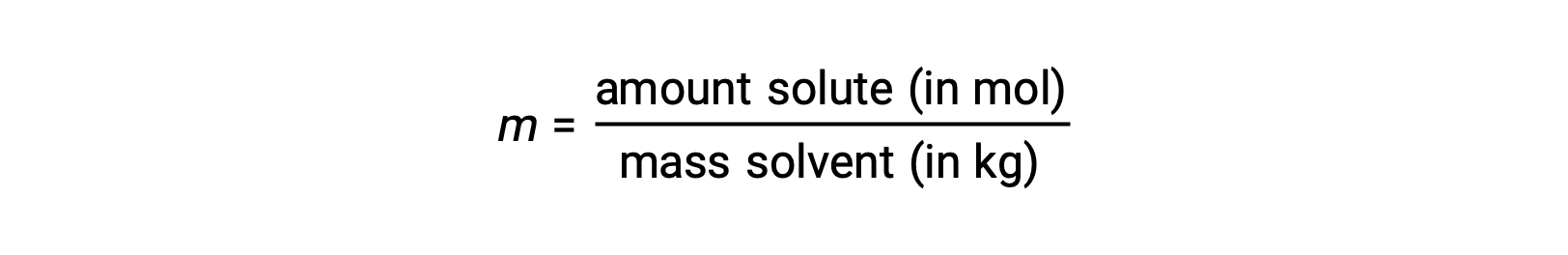
نظراً لأن هذه الوحدات يتم حسابها باستخدام الكتل والكميات المولية فقط، فإنها لا تختلف باختلاف درجة الحرارة، وبالتالي فهي مناسبة بشكل أفضل للتطبيقات التي تتطلب تركيزات لا تعتمد على درجة الحرارة.
هذا النص مقتبس من Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Irving, Harry MNH, Henry Freiser, and Thomas Summers West. Compendium of analytical nomenclature: definitive rules 1977. Elsevier, 2017.
