12.7:
Expressão da Concentração das Soluções
12.7:
Expressão da Concentração das Soluções
Um soluto é um componente de uma solução que normalmente está presente com uma concentração muito inferior à do solvente. As concentrações de solutos são frequentemente descritas com termos qualitativos, tais como diluídas (de concentração relativamente baixa) e concentradas (de concentração relativamente elevada).
As concentrações podem ser avaliadas quantitativamente utilizando uma grande variedade de unidades de medida, cada uma delas conveniente para aplicações específicas. A molaridade (M) é uma unidade de concentração útil para muitas aplicações em química. A molaridade é definida como a quantidade de soluto em número de moles dividida pelo volume da solução em litros:

Como os volumes da solução variam com a temperatura, as concentrações molares também variam. Quando expressa como molaridade, a concentração de uma solução com números idênticos de espécies de solutos e solventes será diferente a diferentes temperaturas devido à contração/expansão da solução. Mais adequado para cálculos envolvendo muitas propriedades coligativas são unidades de concentração baseadas em moles cujos valores não dependem da temperatura. Duas dessas unidades são a fração molar (introduzida no capítulo anterior sobre gases) e a molalidade.
A fração molar, χA, de um componente é a razão da sua quantidade molar por número total de moles de todos os componentes da solução:
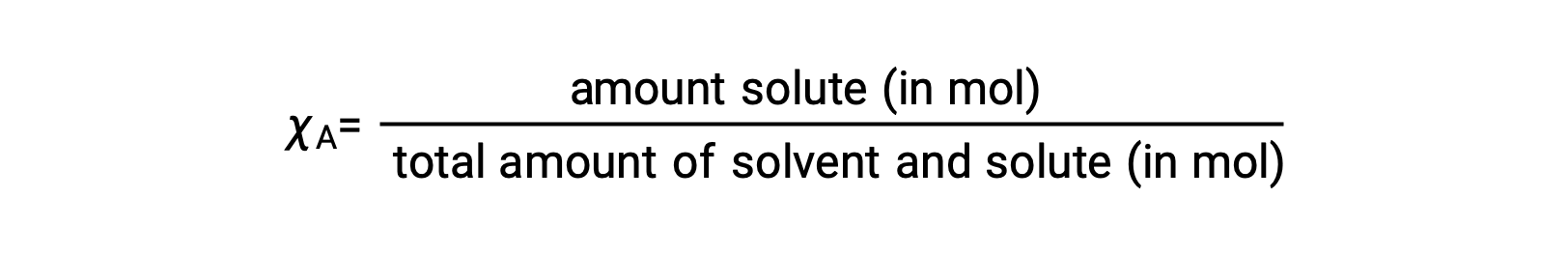
Por esta definição, a soma das frações molares para todos os componentes da solução (o solvente e todos os solutos) é igual a um.
Molalidade é uma unidade de concentração definida como a relação entre o número de moles de soluto e a massa do solvente em quilogramas:
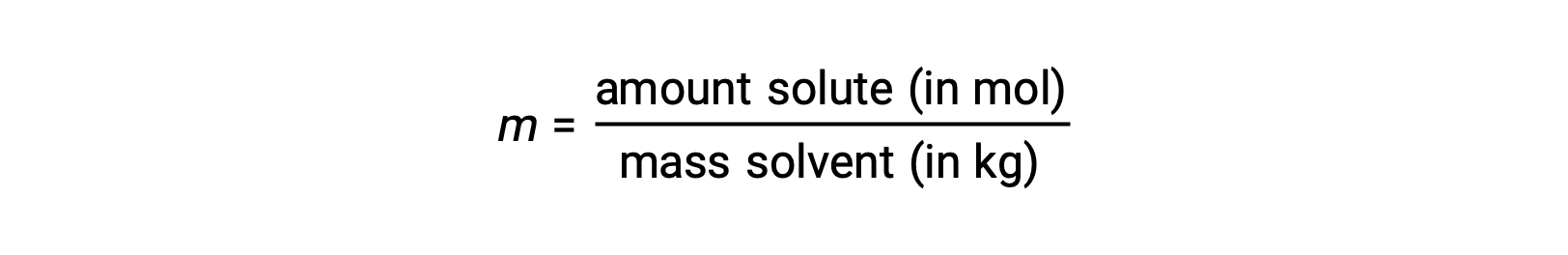
Uma vez que estas unidades são calculadas utilizando apenas massas e quantidades molares, não variam com a temperatura e, por conseguinte, são mais adequadas para aplicações que requerem concentrações independentes da temperatura.
Este texto é adaptado de Openstax, Chemistry 2e, Section 11.4: Colligative Properties.
Suggested Reading
- Irving, Harry MNH, Henry Freiser, and Thomas Summers West. Compendium of analytical nomenclature: definitive rules 1977. Elsevier, 2017.
