12.7:
Esprimere la concentrazione della soluzione
12.7:
Esprimere la concentrazione della soluzione
Un soluto è un componente di una soluzione che è tipicamente presente ad una concentrazione molto inferiore rispetto al solvente. Le concentrazioni di soluto sono spesso descritte con termini qualitativi come diluito (di concentrazione relativamente bassa) e concentrato (di concentrazione relativamente elevata).
Le concentrazioni possono essere valutate quantitativamente utilizzando un’ampia varietà di unità di misura, ciascuna conveniente per particolari applicazioni. La molarità (M) è un’utile unità di concentrazione per molte applicazioni in chimica. La molarità è definita come la quantità di soluto in numero di talpe divise per il volume della soluzione in litri:

Poiché i volumi della soluzione variano con la temperatura, anche le concentrazioni molare varieranno. Se espressa in molarità, la concentrazione di una soluzione con un numero identico di specie di soluto e solvente sarà diversa a temperature diverse a causa della contrazione/espansione della soluzione. Più appropriato per i calcoli che coinvolgono molte proprietà colligative sono unità di concentrazione a base di talpa i cui valori non dipendono dalla temperatura. Due di queste unità sono la frazione talpa (introdotta nel capitolo precedente sui gas) e la melanalità.
La frazione talpa, χA, di un componente è il rapporto tra la sua quantità molare e il numero totale di talpe di tutti i componenti della soluzione:
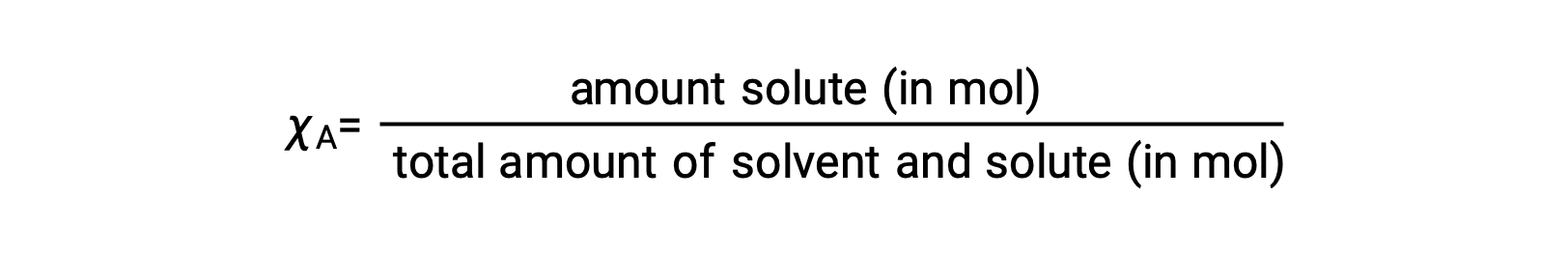
Con questa definizione, la somma delle frazioni di talpa per tutti i componenti della soluzione (il solvente e tutti i soluti) è uguale a uno.
La molalità è un’unità di concentrazione definita come il rapporto tra il numero di talpe di soluto e la massa del solvente in chilogrammi:

Poiché queste unità sono calcolate utilizzando solo masse e quantità molare, non variano con la temperatura e, quindi, sono più adatte per applicazioni che richiedono concentrazioni indipendenti dalla temperatura.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 11.4: Proprietà Colligative.
Suggested Reading
- Irving, Harry MNH, Henry Freiser, and Thomas Summers West. Compendium of analytical nomenclature: definitive rules 1977. Elsevier, 2017.
