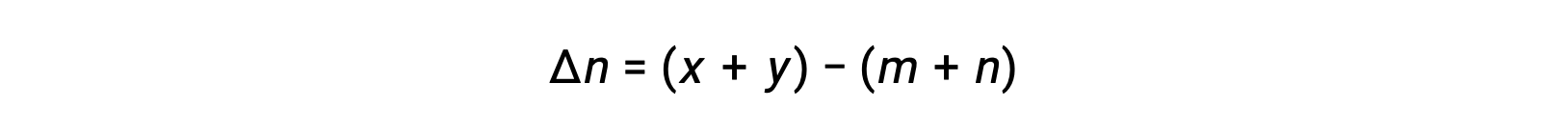14.3:
기체 반응과 불균일계 반응의 평형
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Homogeneous Equilibria for Gaseous Reactions
반응물과 생성물이 모두 기체인 화학 반응의 경우 평형 상수도 몰 농도보다는 개별적인 부분 압력을 사용하여 계산할 수 있습니다. 따라서 기체 A와 B가 역반응에서 기체 C와 D로 변환될 때, 평형식은 각 기체의 부분 압력으로 대신 작성될 수 있으며 각 기체의 부분 압력은 화학양론계수로 제곱됩니다. 평형 상수는 Kp로 지정됩니다.여기서 첨자 p는 압력을 나타냅니다. 주어진 기체 반응의 경우 기체의 부분 압력과 몰 농도는 별개의 값이기 때문에 Kp는 반드시 Kc와 같다고 볼 수 없습니다. 그러나 이상적인 기체 방정식과 몰 농도의 정의를 사용하여 두 상수 사이의 관계를 도출할 수 있습니다.이 관계를 유도하기 위해 주어진 화학 반응에 대한 Kc와 Kp의 평형식을 고려합니다. 이상적인 기체 방정식에서는 기체의 압력과 해당 온도에서 몰의 수 및 부피를 연관시킵니다. 이상적인 기체 방정식에서 몰 비를 몰 농도에 대한 부피로 치환하여 몰 농도의 관점에서 이상 기체의 압력을 표현할 수 있습니다.이러한 방식으로 Kp에 대한 표현식의 개별 부분 압력은 각 기체에 해당하는 농도로 대체할 수 있습니다. 화학양론계수는 변경되지 않습니다. 수정된 Kp 식에서, 생성물의 농도와 반응물의 농도의 비율로 Kc를 대체할 수 있습니다.이 방정식은 두 상수 간의 관계를 나타냅니다-Kp는 Kc 곱하기 RT에 생성물의 계수의 합에서 반응물 계수의 합을 뺀 값을 제곱한 것과 같습니다. 기체 반응물과 생성물의 계수 간의 차이를 델타 n이라고 표현할 수 있습니다.
14.3:
기체 반응과 불균일계 반응의 평형
기체 반응을 위한 동질적인 평형
가스상 반응의 경우, 평형 상수는 반응제 및 제품의 어금니농도(Kc)또는 부분 압력(Kp)의관점에서 발현될 수 있다. 이 두 K 값 간의 관계는 단순히 이상적인 가스 방정식과 어금니정의 정의에서 파생될 수 있습니다. 이상적인 가스 방정식에 따르면:
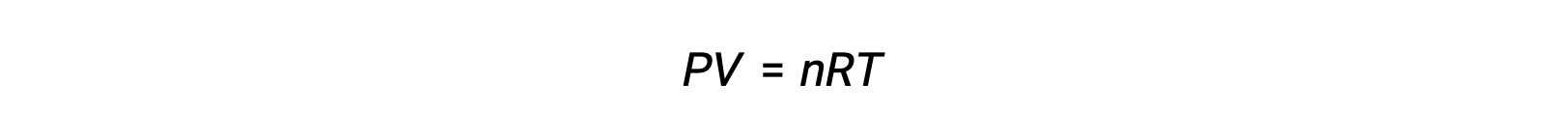
어금니 농도 또는 어모는 볼륨으로 나눈 두더지의 수에 의해 주어집니다:
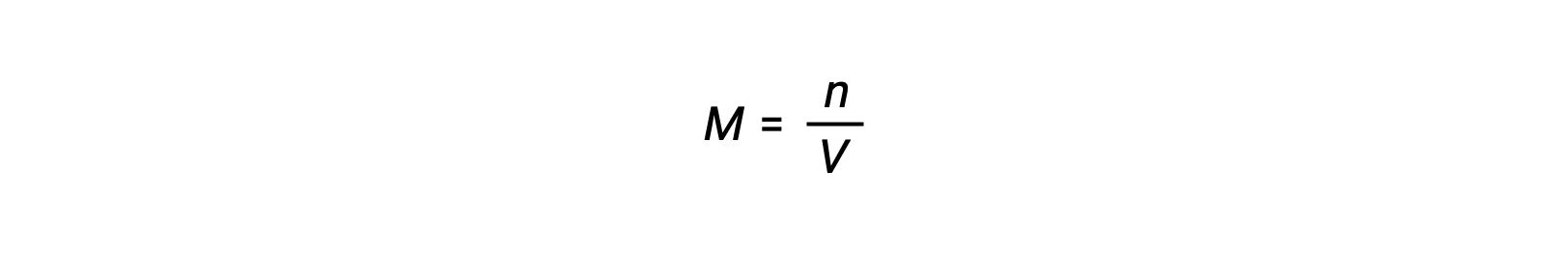
따라서
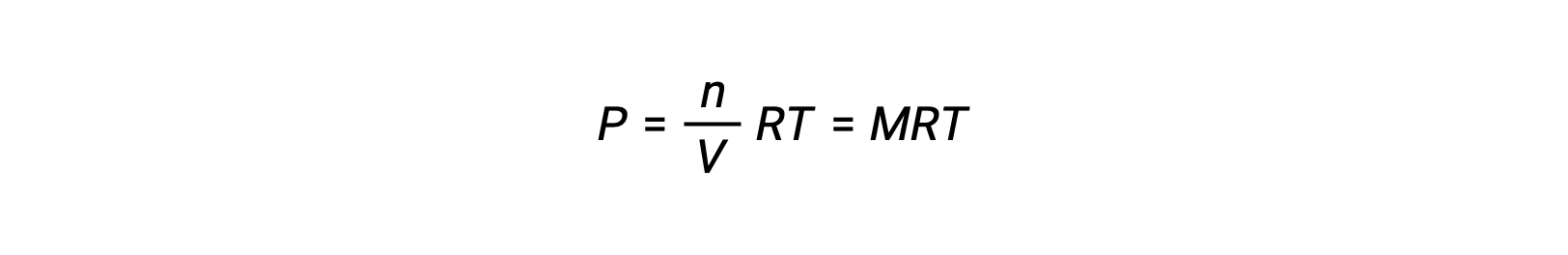
P가 부분압력인 경우, V는 부피이고, n은 두더지의 수이고, R은 가스 상수, T는 온도이고, M은 어금니 농도이다.
가스 상 반응: m A + n B ⇌ x C + y D
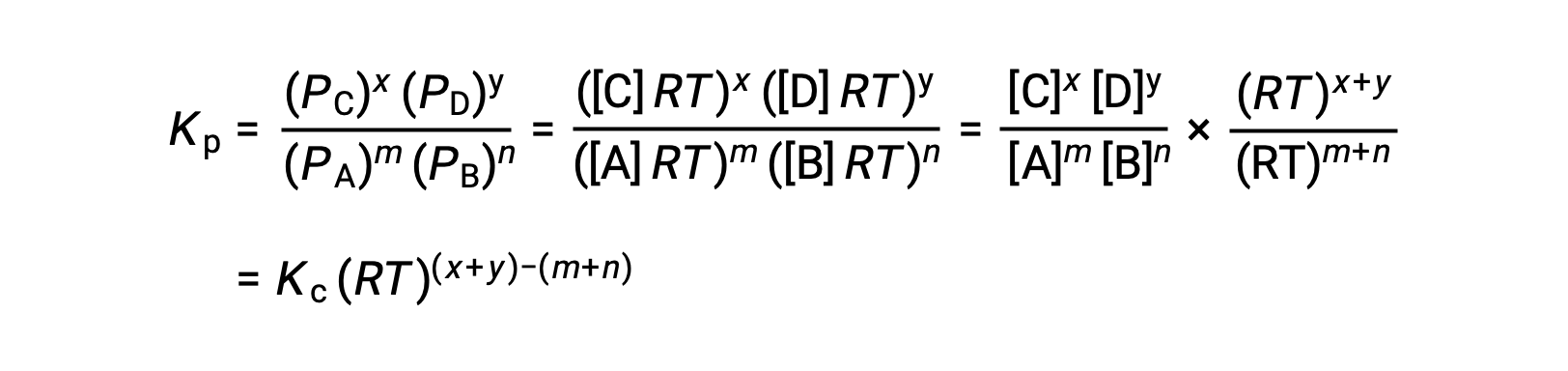
그래서KC와 KP의 관계는
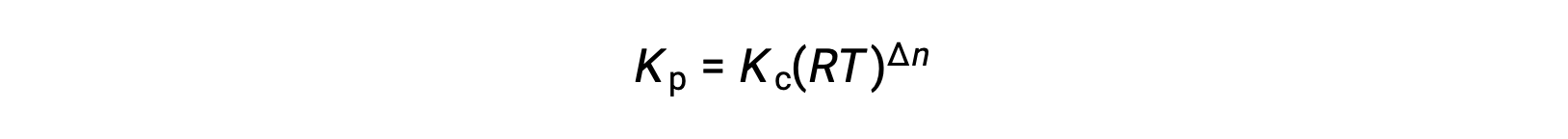
여기서 Δn은 제품 및 반응제 가스의 어금다량의 차이입니다.