14.3:
Équilibre homogène pour les réactions gazeuses
14.3:
Équilibre homogène pour les réactions gazeuses
Équilibre homogène pour les réactions gazeuses
Pour les réactions en phase gazeuse, la constante d’équilibre peut être exprimée en termes de concentrations molaires (Kc) ou de pressions partielles (Kp) des réactifs et des produits. Une relation entre ces deux valeurs de K peut être simplement déduite de l’équation des gaz parfaits et de la définition de la molarité. Selon l’équation des gaz parfaits :
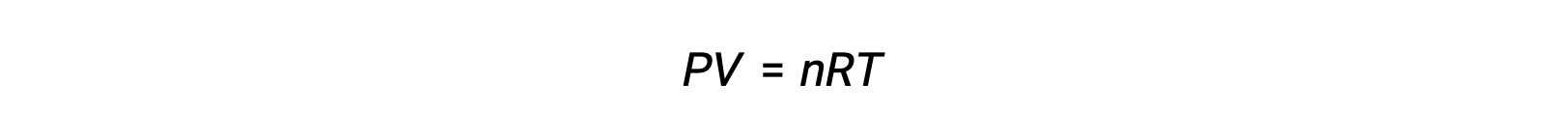
La concentration molaire ou la molarité est donnée par le nombre de moles divisé par le volume :
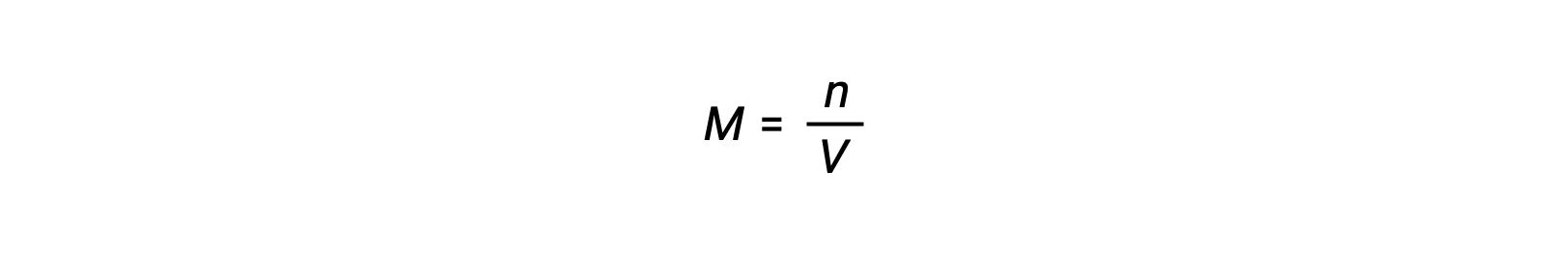
Ainsi,
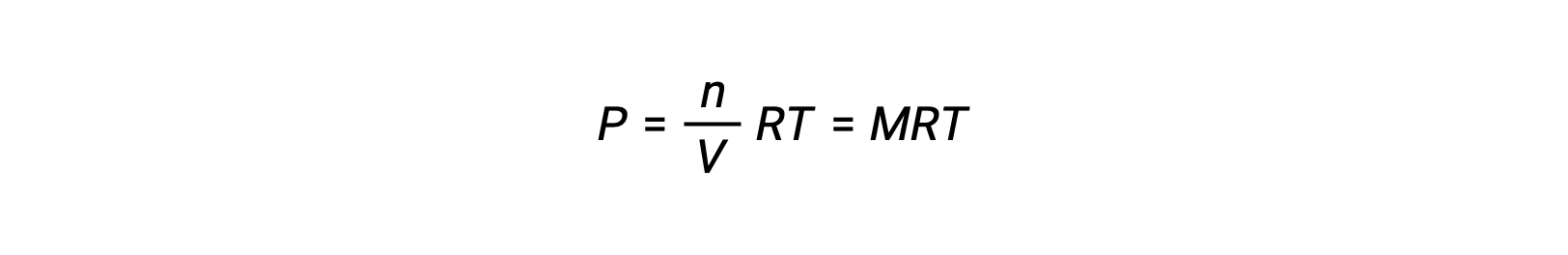
où P est la pression partielle, V le volume, n le nombre de moles, R la constante des gaz, T la température et M la concentration molaire.
Pour la réaction en phase gazeuse : m A + n B ⇌ x C + y D
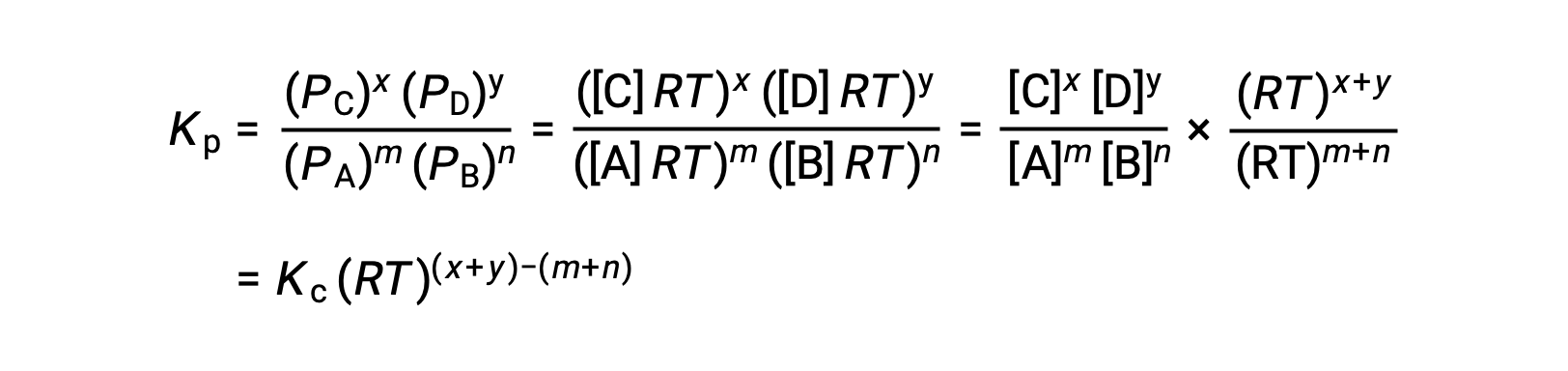
Ainsi, la relation entre Kc et Kp est
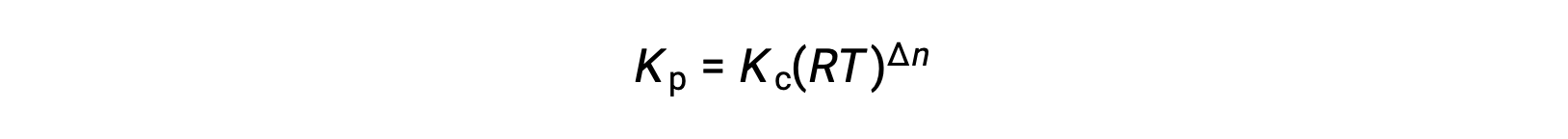
où Δn est la différence entre les quantités molaires des produits et réactifs gazeux, dans ce cas :
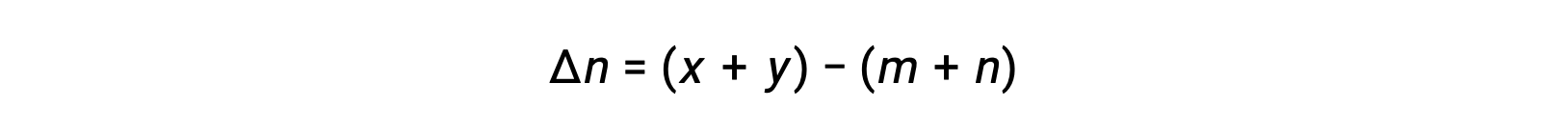
Ce texte a été adapté de Openstax, Chimie 2e, Section 13.2 Constantes d’équilibre.
