14.4:
Cálculo da Constante de Equilíbrio
14.4:
Cálculo da Constante de Equilíbrio
A constante de equilíbrio para uma reação é calculada a partir das concentrações de equilíbrio (ou pressões) dos seus reagentes e produtos. Se estas concentrações forem conhecidas, o cálculo envolve simplesmente a sua substituição na expressão Kc.
Por exemplo, o dióxido de nitrogénio gasoso forma tetróxido de dinitrogénio de acordo com esta equação:
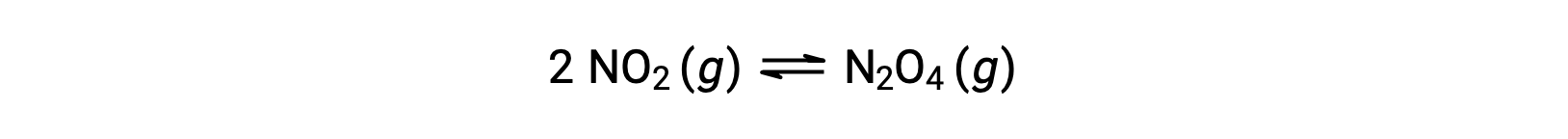
Quando se adiciona 0,10 mol de NO2 a um frasco de 1,0 L a 25 °C, a concentração muda de modo a que, em equilíbrio, [NO2] = 0,016 M e [N2O4] = 0,042 M. O valor da constante de equilíbrio para a reação pode ser calculado da seguinte forma:
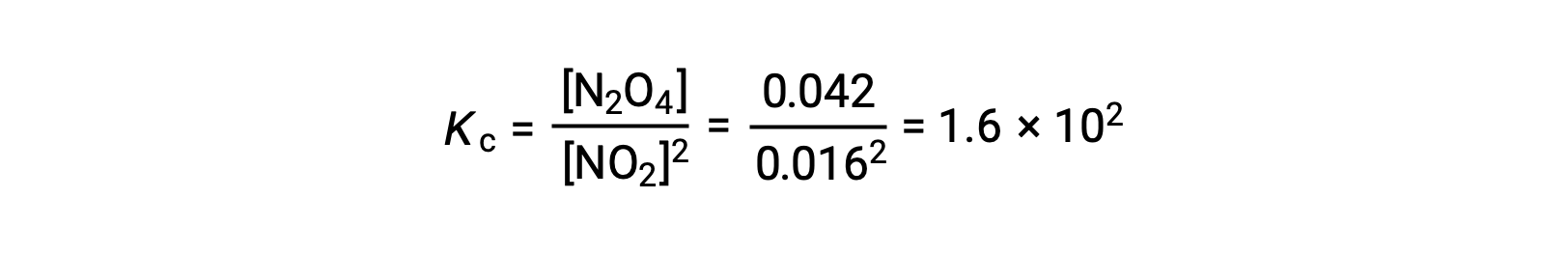
Um exemplo um pouco mais desafiante é mostrado a seguir, no qual a estequiometria da reação é usada para derivar concentrações de equilíbrio a partir da informação fornecida. A estratégia básica desta computação é útil para muitos tipos de cálculos de equilíbrio e depende do uso de termos para as concentrações de reagentes e produtos inicialmente presentes, para como elas mudam à medida que a reação prossegue, e para o que elas são quando o sistema atinge o equilíbrio. O acrónimo ICE é comumente usado para referir essa abordagem matemática, e os termos de concentração são geralmente reunidos em um formato tabular chamado de tabela ICE.
Cálculo de uma Constante de Equilíbrio
As moléculas de iodo reagem reversivelmente com iões iodeto para produzir iões triiodeto.
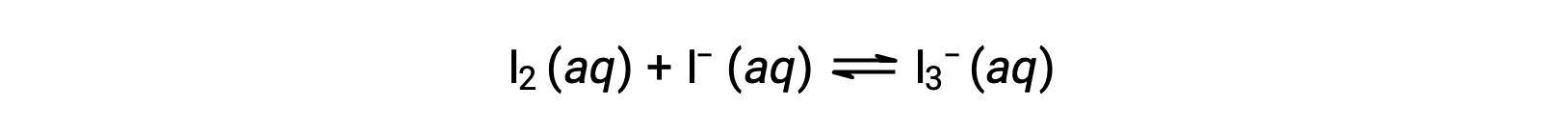
Se uma solução com concentrações de I2 e I− ambas iguais a 1,000 × 10−3 M antes da reação der uma concentração de equilíbrio de I2 de 6,61 × 10−4 M, qual é a constante de equilíbrio para a reação?
Para calcular as constantes de equilíbrio, são necessárias concentrações de equilíbrio para todos os reagentes e produtos:
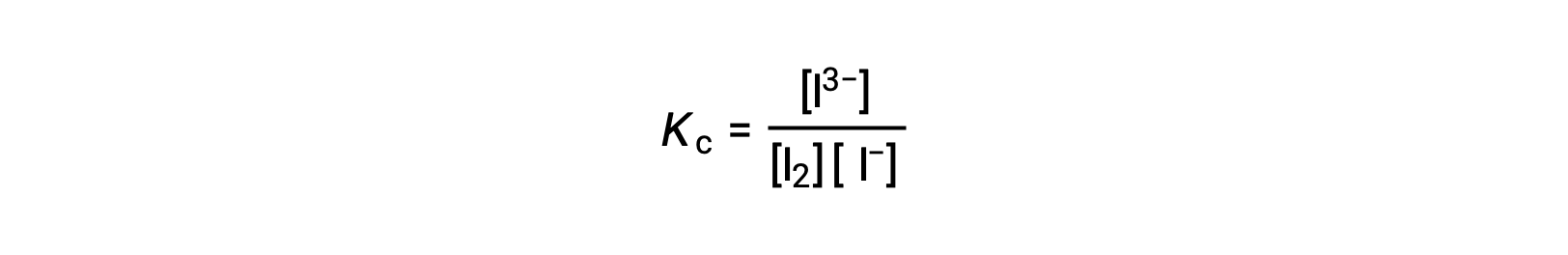
São fornecidas as concentrações iniciais dos reagentes e a concentração de equilíbrio do produto. Esta informação pode ser usada para derivar termos para as concentrações de equilíbrio dos reagentes, apresentando todas as informações em uma tabela ICE.
| I2 (aq) | I− (aq) | I3− (aq) | |
| Concentração Inicial (M) | 1,000 × 10−3 | 1,000 × 10−3 | 0 |
| Alteração (M) | −x | −x | +x |
| Concentração em Equilíbrio (M) | 1,000 × 10−3 − x | 1,000 × 10-3 − x | x |
Em equilíbrio a concentração de I2 é 6,61 × 10−4 M por isso
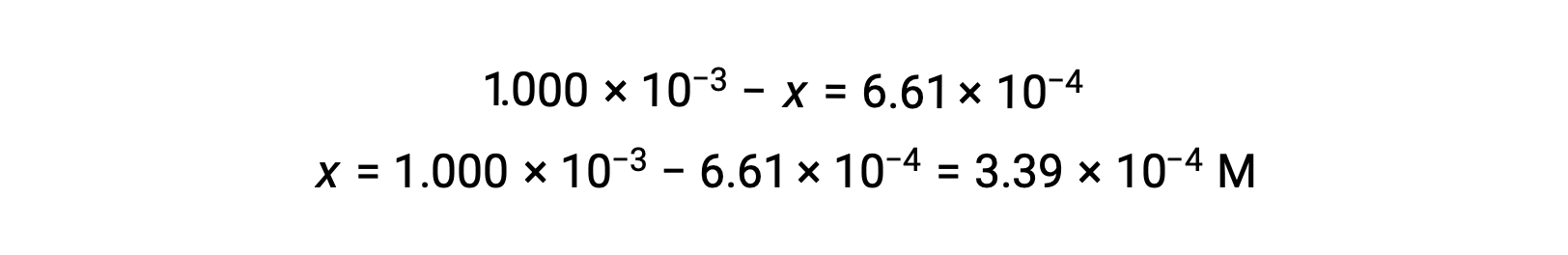
A tabela ICE pode agora ser atualizada com valores numéricos para todas as suas concentrações:
| I2 (aq) | I− (aq) | I3− (aq) | |
| Concentration Inicial (M) | 1,000 × 10−3 | 1,000 × 10−3 | 0 |
| Alteração (M) | −3,39 × 10−4 | −3,39 × 10−4 | +3,39 × 10-4 |
| Concentração em Equilíbrio (M) | 6,61 × 10−4 | 6,61 × 10−4 | 3,39 × 10−4 |
Por fim, as concentrações de equilíbrio podem ser substituídas na expressão Kc e resolvidas:
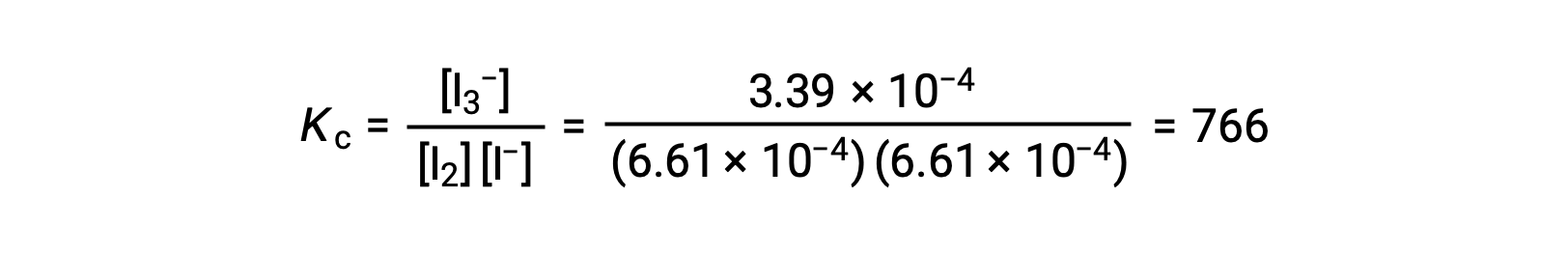
Este texto foi adaptado de Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
