14.4:
Расчет константы равновесия
14.4:
Расчет константы равновесия
Константа равновесия для реакции рассчитывается на основе равновесных концентраций (или давлений) ее реагенты и продуктов. Если эти концентрации известны, расчет просто включает их замену в выражение Kc.
Например, газообразный диоксид азота образует тетраоксид динитрогена по этому уравнению:
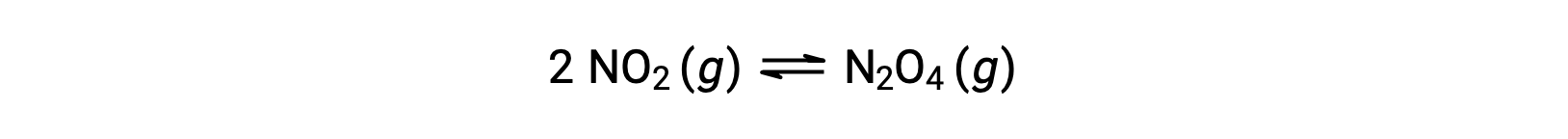
При добавлении 0.10 моль NО2 к фласке объемом 1.0 л при температуре 25 °C концентрация изменяется таким образом, что при равновесии, [NО2] = 0.016 м и [N2O4] = 0.042 M. значение равновесной постоянной для реакции можно рассчитать следующим образом:
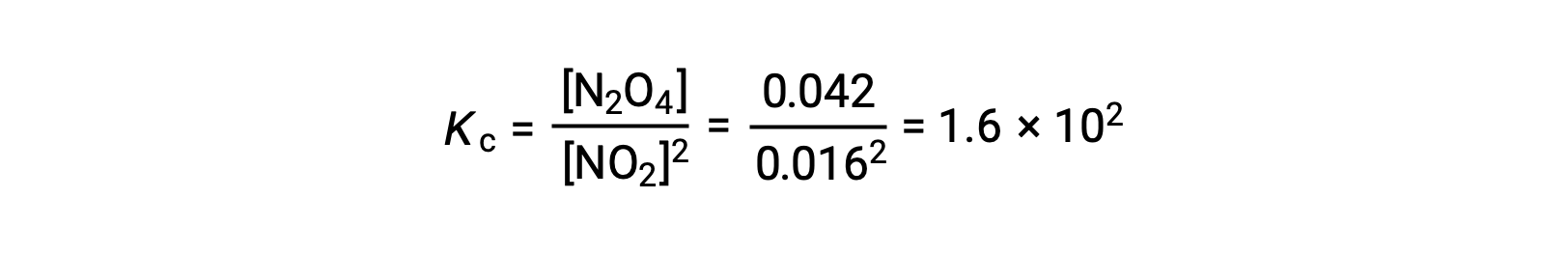
Далее приводится несколько более сложный пример, в котором стехиометрия реакции используется для получения равновесных концентраций на основе предоставленной информации. Основная стратегия этих вычислений полезна для многих типов вычислений равновесия и основана на использовании терминов для концентраций реагент и продуктов, которые изначально присутствуют, для того, как они изменяются по мере реакции, и для того, что они являются, когда система достигает равновесия. Аббревиатура ICE обычно используется для обозначения этого математического подхода, и термины концентрации обычно собираются в табличном формате, называемом таблицей ICE.
Расчет константы равновесия
Молекулы йода реагируют ревербератно с ионами йодида, образуя трийодиды.
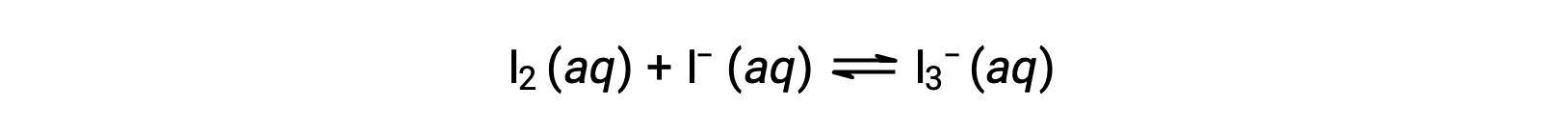
Если раствор с концентрациями I2 и I- равны 1.000 × 10-3 M до реакции, то какова равновесная концентрация I2 6.61 × 10-4 M?
Для расчета констант равновесия необходимо определить равновесные концентрации для всех реагенты и продуктов:
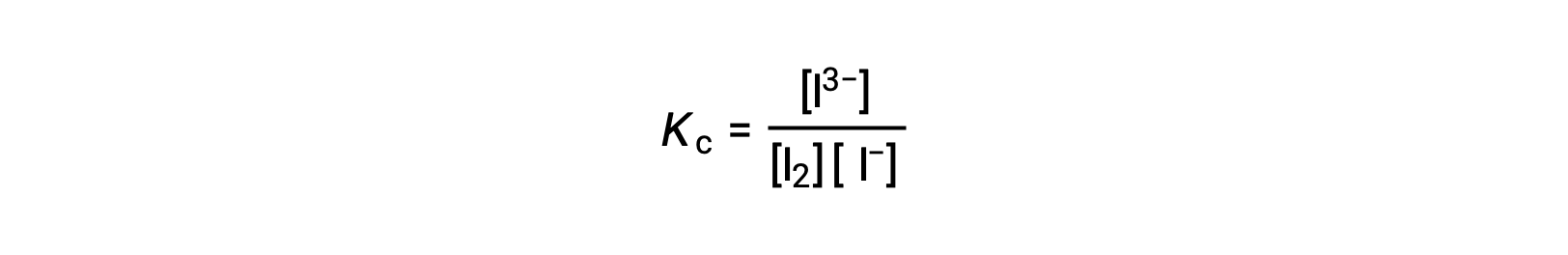
Приведены начальные концентрации реагенты и равновесная концентрация продукта. Эту информацию можно использовать для определения равновесных концентраций реагенты, представляя всю информацию в таблице ICE.
| I2 (aq) | I− (aq) | I3− (aq) | |
| Начальная концентрация (M) | 1.000 × 10-3 | 1.000 × 10-3 | 0 |
| Изменение (M) | x | x | +x. |
| Равновесная концентрация (M) | 1.000 × 10-3 – x. | 1.000 × 10-3 – x. | x |
При равновесии концентрация I2 составляет 6.61 × 10-4 м так, что
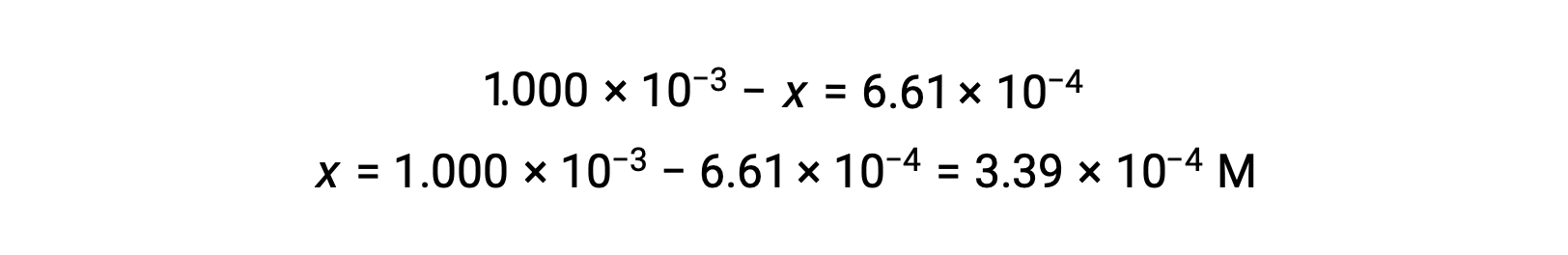
Теперь таблицу ICE можно обновить числовыми значениями для всех ее концентраций:
| I2 (aq) | I– (Aq) | I3– (aq) | |
| Начальная концентрация (M) | 1.000 × 10-3 | 1.000 × 10-3 | 0 |
| Изменение (M) | 3.39 × 10-4 | 3.39 × 10-4 | +3,39 × 10-4 |
| Равновесная концентрация (M) | 6.61 × 10-4 | 6.61 × 10-4 | 3.39 × 10-4 |
Наконец, равновесные концентрации могут быть заменены на выражение Kc и решены:
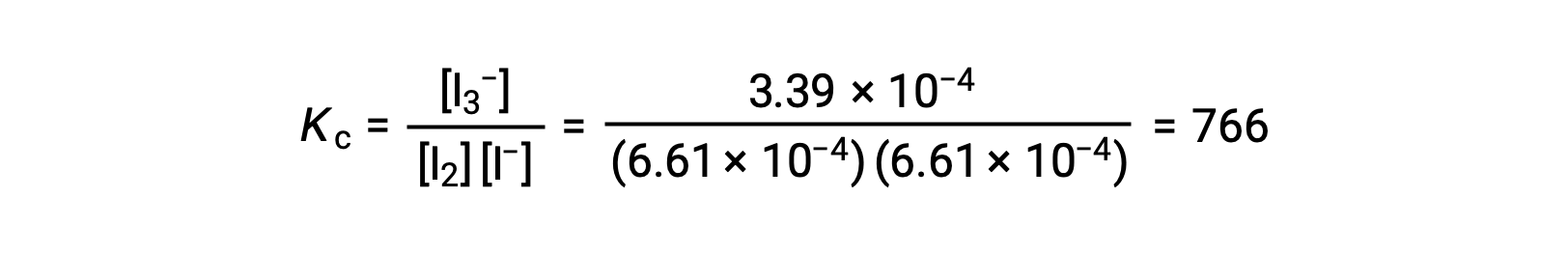
Этот текст был адаптирован к расчетам равновесия Openstax, Химия 2е изд., раздел 13.4.
