14.4:
Calcul de la constante d'équilibre
14.4:
Calcul de la constante d'équilibre
La constante d’équilibre d’une réaction est calculée à partir des concentrations (ou pressions) à l’équilibre de ses réactifs et produits. Si ces concentrations sont connues, le calcul implique simplement leur substitution dans l’expression de Kc.
Par exemple, le dioxyde d’azote gazeux forme du tétraoxyde de diazote selon cette équation :
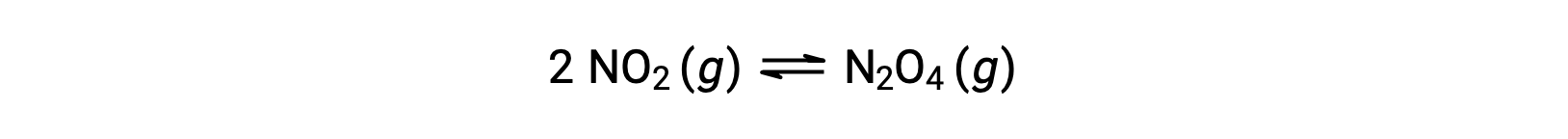
Lorsque 0,10 mol de NO2 est ajouté à une fiole de 1,0 L à 25 °C, la concentration change de sorte qu’à l’équilibre, [NO2] = 0,016 M et [N2O4] = 0,042 M. La valeur de la constante d’équilibre pour la réaction peut être calculée comme suit :
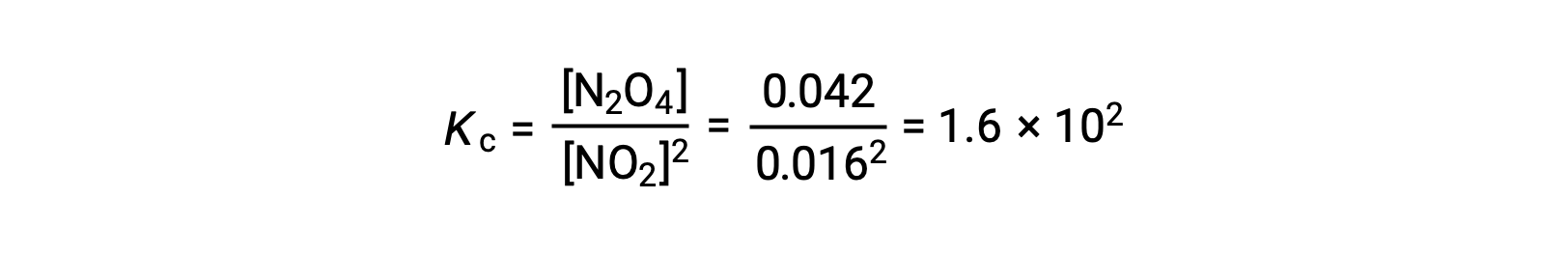
Un exemple un peu plus difficile est fourni ensuite, dans lequel la stœchiométrie de la réaction est utilisée pour déduire les concentrations à l’équilibre à partir des informations fournies. La stratégie de base de ce calcul est utile pour de nombreux types de calculs d’équilibre et repose sur l’utilisation de termes pour les concentrations de réactif et de produit initialement présentes, pour la façon dont elles changent au fur et à mesure que la réaction se produit, et pour ce qu’elles sont quand le système atteint l’équilibre. L’acronyme ICE est couramment utilisé pour faire référence à cette approche mathématique, et les termes de la concentration sont généralement rassemblés sous un format tabulaire appelé un tableau ICE.
Calcul d’une constante d’équilibre
Les molécules d’iode réagissent de façon réversible avec les ions iodure pour produire des ions triiodure.
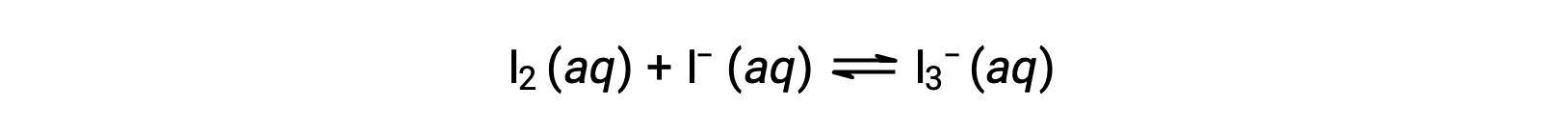
Si une solution ayant des concentrations de I2 et de I− toutes deux égales à 1,000 × 10−3 M avant la réaction donne une concentration à l’équilibre pour I2 de 6,61 × 10−4 M, quelle est la constante d’équilibre de la réaction ?
Pour calculer les constantes d’équilibre, les concentrations à l’équilibre sont nécessaires pour tous les réactifs et produits :
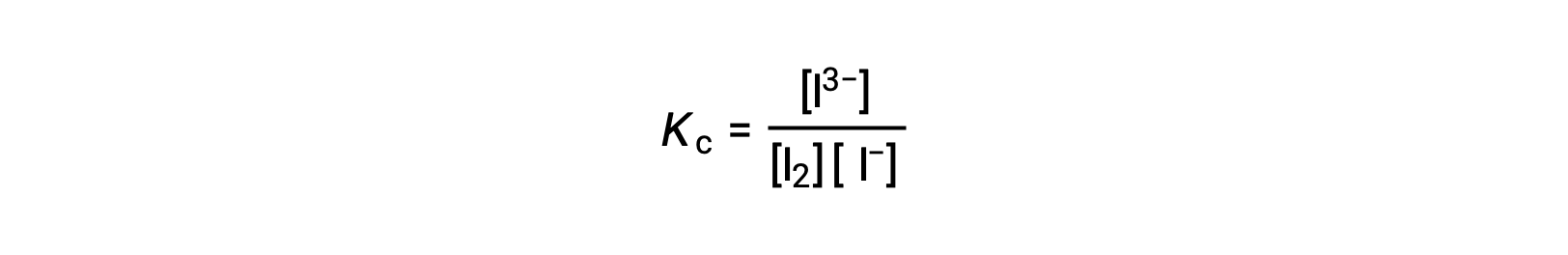
Les concentrations initiales des réactifs et la concentration à l’équilibre du produit sont fournies. Ces informations peuvent être utilisées pour calculer les termes des concentrations à l’équilibre des réactifs, en présentant toutes les informations dans un tableau ICE.
| I2 (aq) | I− (aq) | I3− (aq) | |
| Concentration initiale (M) | 1,000 × 10−3 | 1,000 × 10−3 | 0 |
| Changement (M) | −x | −x | +x |
| Concentration à l’équilibre (M) | 1,000 × 10−3 − x | 1,000 × 10-3 − x | x |
À l’équilibre, la concentration de I2 est de 6,61 × 10−4 M donc
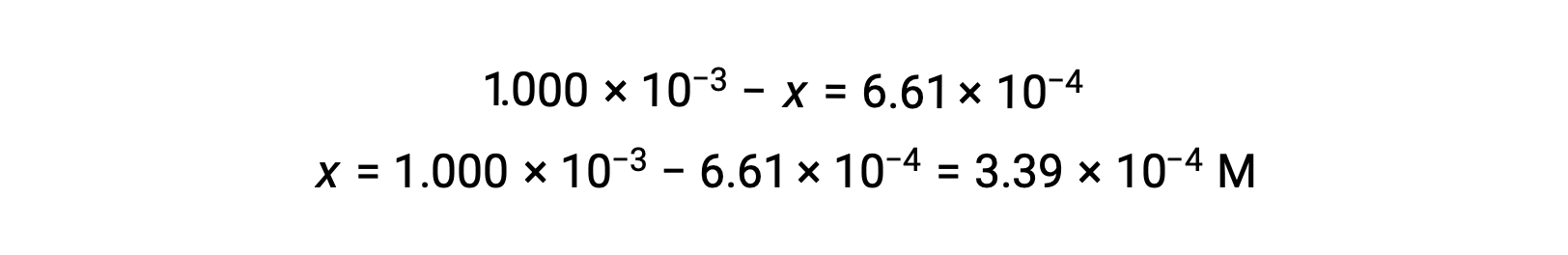
Le tableau ICE peut maintenant être mis à jour avec des valeurs numériques pour toutes ses concentrations :
| I2 (aq) | I− (aq) | I3− (aq) | |
| Concentration initiale (M) | 1,000 × 10−3 | 1,000 × 10−3 | 0 |
| Changement (M) | −3,39 × 10−4 | −3,39 × 10−4 | +3,39 × 10-4 |
| Concentration à l’équilibre (M) | 6,61 × 10−4 | 6,61 × 10−4 | 3,39 × 10−4 |
Enfin, les concentrations à l’équilibre peuvent être substituées dans l’expression de Kc et résolues :
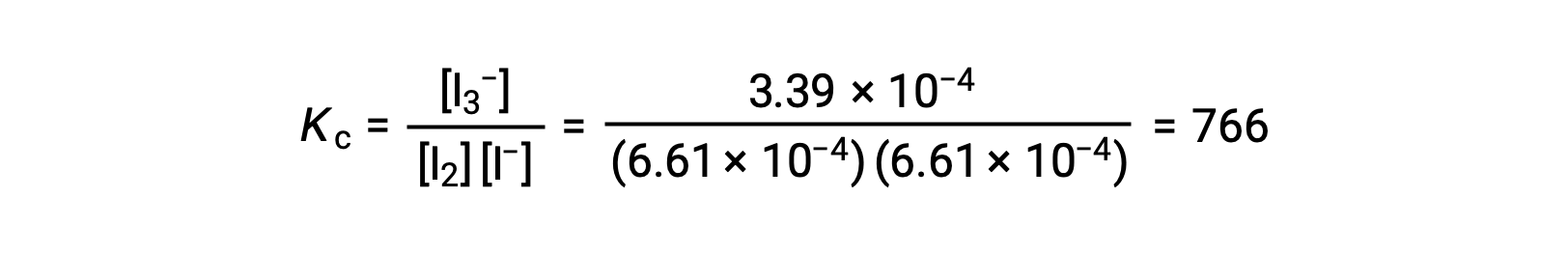
Ce texte a été adapté d’Openstax, Chimie 2e, Section 13.4 Calculs d’équilibre.
