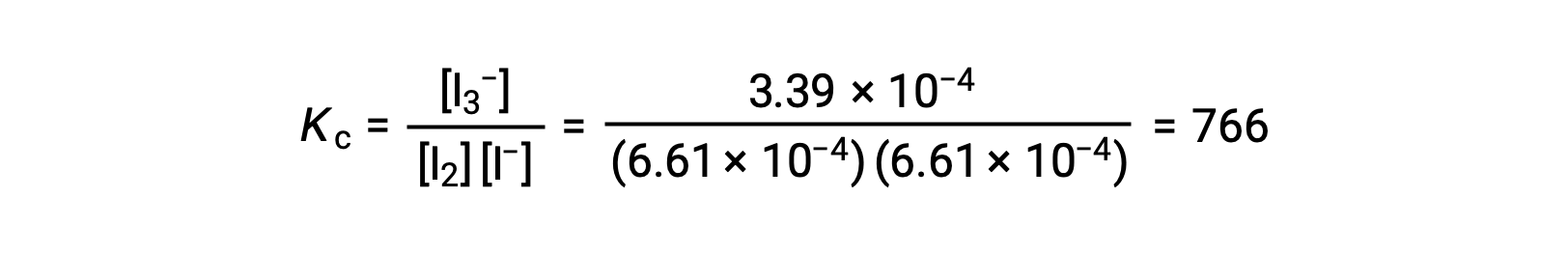14.4:
计算平衡常数
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Calculating the Equilibrium Constant
如果平衡时所有反应物 和产物的浓度已知,平衡常数 Kc 可以 通过将相应值代入平衡常数 表达式来确定。二氧化硫和氧气的气体混合物 在 530 摄氏度下可以 根据所示的反应进行反应。在平衡状态下,混合物含有 0.10 摩尔的 二氧化硫、0.15 摩尔的氧气和 10.88 摩尔的 三氧化硫。通过将这些值代入平衡表达式,Kc 等于 7.9×10⁴。只要所有组分的初始浓度 和至少一种化合物的 平衡浓度已知,也可以计算 Kc。未知的平衡浓度 可以随后使用反应化学计量法进行计算。一个 ICE 表可用于组织 反应的初始、变化和平衡 浓度的信息。当含有 0.11 摩尔氮气 和 0.36 摩尔氢气的反应混合物 在 500℃下被允许达到平衡,它在平衡时 产生 0.020 摩尔的氨气。为了计算 Kc,需要确定氮气 和氢气的平衡浓度。反应的化学计量表明,产生 2 摩尔氨气需要 1 摩尔氮气和 3 摩尔氢气。当乘以反应物和产物的系数时,变化量 x,表示为达到平衡 所消耗的反应物的浓度和 所产生的产物的浓度。因为 2x 等于 0.020,x 等于 0.010。然后可以通过从初始浓度中减去相应的浓度变化 来确定氮气和氢气的平衡浓度,它们分别等于 0.10 和 0.33 摩尔。将平衡浓度代入 Kc 表达式,Kc 等于 0.11。气体反应的 Kp 可以用 ICE 表和用分压 写出的平衡表达式来计算。
14.4:
计算平衡常数
反应的平衡常数是根据其反应物和生成物的平衡浓度 (或压力) 计算得出的。 如果已知这些浓度,计算结果只是将其替换为 KC 表达式。
例如,根据该方程,气体二氧化氮形成二氧化丁氮氧化物:
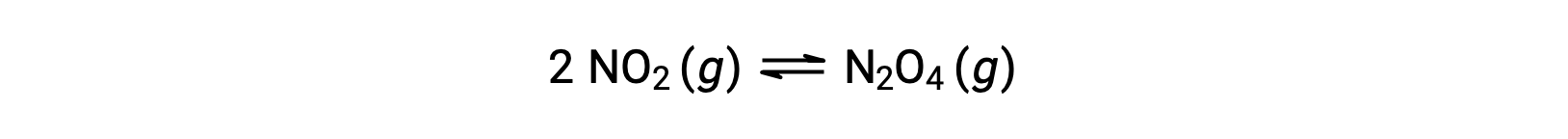
当在 25 °C 条件下将 0.10 mol NO2 添加到 1.0-L 瓶中时,浓度会发生变化,因此在平衡状态下, [NO2] = 0.016 M , [N2O4] = 0.042 M。 反应的平衡常数的值可以按以下公式计算:
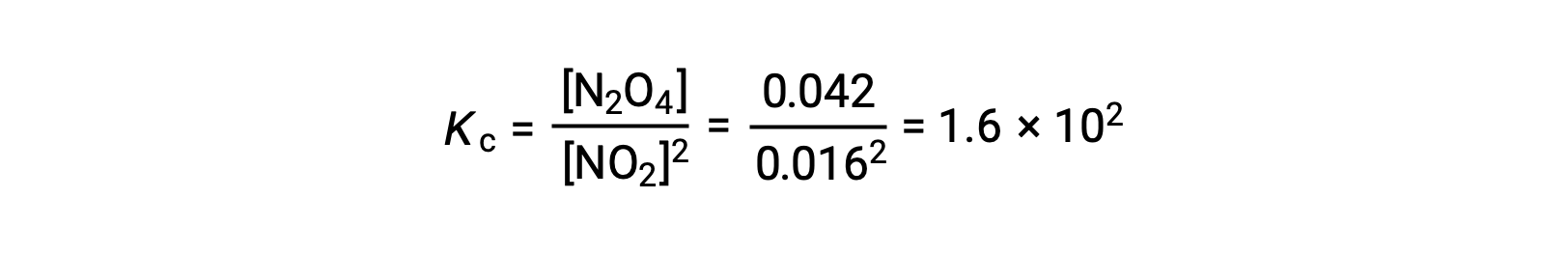
接下来将提供一个略具挑战性的示例,其中使用反应化学计量法从提供的信息中得出平衡浓度。 这种计算的基本策略对许多类型的平衡计算非常有用,并且依赖于使用最初出现的反应物和生成物浓度的术语,它们在反应过程中的变化以及系统达到平衡时的变化。 首字母缩略词 ICE 通常用于引用此数学方法,浓度术语通常以表格形式收集,称为 ICE 表。
平衡常数的计算
碘分子与碘离子发生可逆反应,以产生三碘离子。
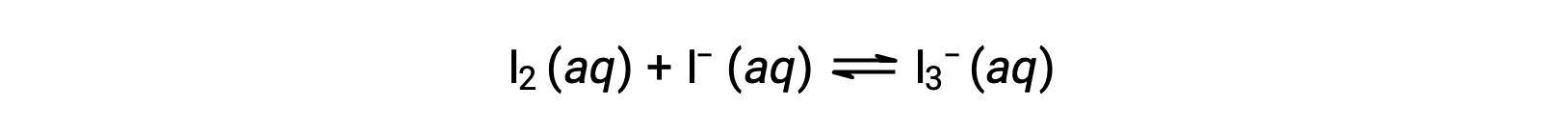
如果反应前 I2 和 I− 的浓度均等于 1000 × 10−3 M 的溶液产生 6.61 × 10−4 M 的 I2 平衡浓度,反应的平衡常数是多少?
要计算平衡常数,所有反应物和生成物都需要平衡浓度:
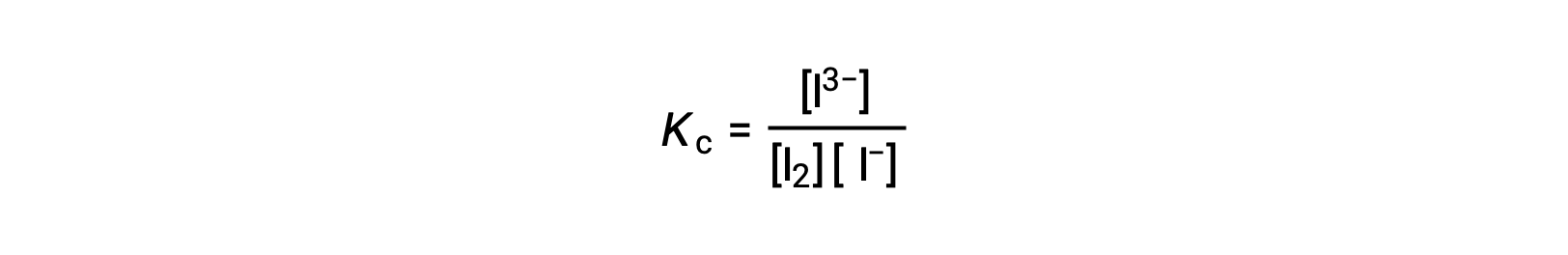
提供了反应物的初始浓度和生成物的平衡浓度。 这些信息可用于为反应物的平衡浓度得出术语,并在 ICE 表中显示所有信息。
| I2 (AQ) | I− (AQ) | i3− (AQ) | |
| 初始浓度 (M) | 1.000 × 10−3. | 1.000 × 10−3. | 0|
| 变化 (M) | −x | −x | +x |
| 平衡浓度 (M) | 1000 × 10−3 − x | 1.000 × 10-3 − x | X |
均衡时, I2 的浓度为 6.61 × 10−4 答
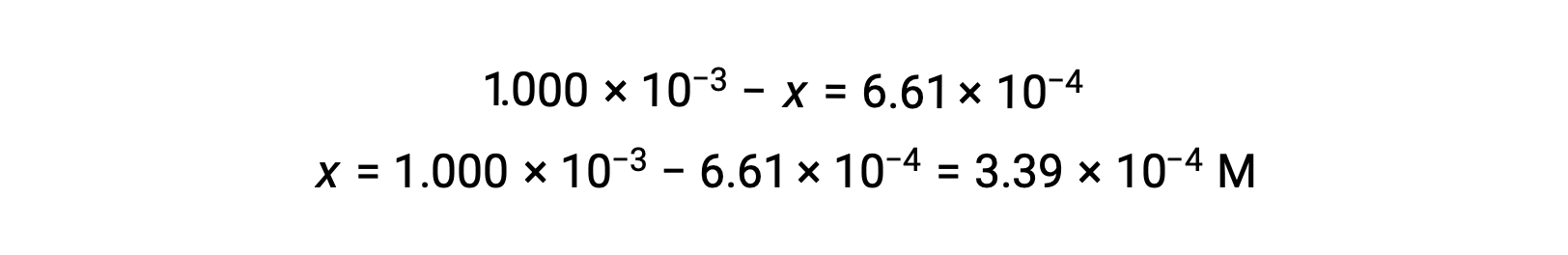
ICE 表现在可以使用所有浓度的数值进行更新:
| I2 (AQ) | I− (AQ) | i3− (AQ) | |
| 初始浓度 (M) | 1.000 × 10−3. | 1.000 × 10−3. | 0|
| 变化 (M) | −3.39 × 10−4. | −3.39 × 10−4. | +3.39 × 10-4. |
| 平衡浓度 (M) | 6.61 × 10−4. | 6.61 × 10−4. | 3.39 × 10−4. |
最后,平衡浓度可以被替代为 KC 表达式并解出: