14.4:
Calcolo della costante di equilibrio
14.4:
Calcolo della costante di equilibrio
La costante di equilibrio per una reazione è calcolata dalle concentrazioni di equilibrio (o pressioni) dei suoi reagenti e prodotti. Se queste concentrazioni sono note, il calcolo comporta semplicemente la loro sostituzione nell’espressione Kc.
Ad esempio, il biossido di azoto gassoso forma tetrossido dinitrogeno secondo questa equazione:
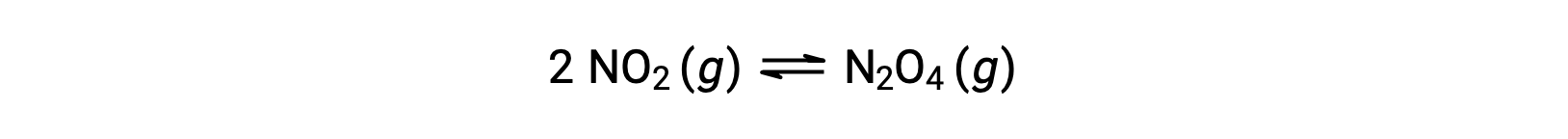
Quando 0,10 mol NO2 viene aggiunto a un pallone da 1,0-L a 25 °C, la concentrazione cambia in modo che all’equilibrio, [NO2] = 0,016 M e [N2O4] = 0,042 M. Il valore della costante di equilibrio per la reazione può essere calcolato come segue:
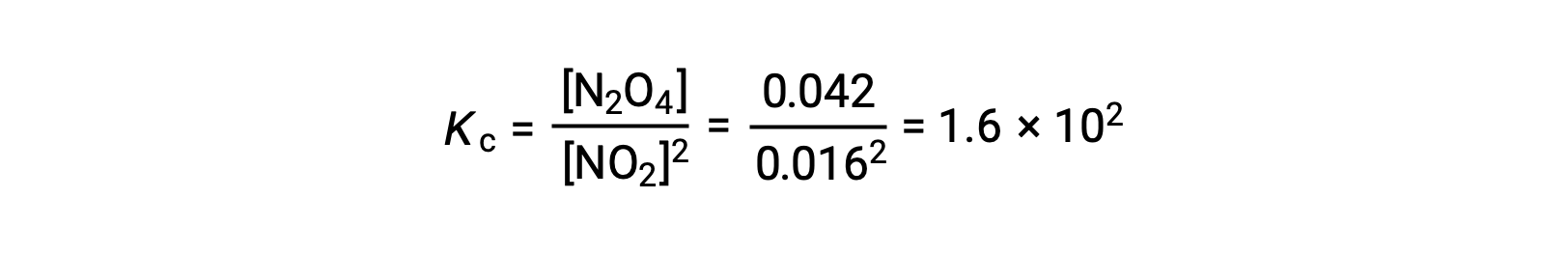
Un esempio leggermente più impegnativo è fornito successivamente, in cui la stechiometria di reazione viene utilizzata per ricavare concentrazioni di equilibrio dalle informazioni fornite. La strategia di base di questo calcolo è utile per molti tipi di calcoli di equilibrio e si basa sull’uso di termini per le concentrazioni di reagenti e prodotti inizialmente presenti, per come cambiano man mano che la reazione procede e per quello che sono quando il sistema raggiunge l’equilibrio. L’acronimo ICE è comunemente usato per riferirsi a questo approccio matematico, e i termini di concentrazione sono solitamente raccolti in un formato tabulare chiamato tabella ICE.
Calcolo di una costante di equilibrio
Le molecole di iodio reagiscono reversibilmente con ioni ioduro per produrre ioni triioduro.
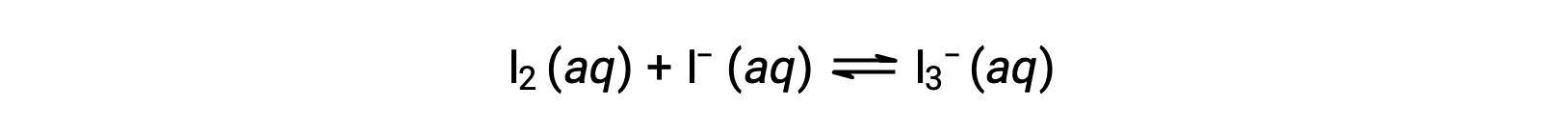
Se una soluzione con le concentrazioni di I2 e I− entrambe uguali a 1.000 × 10−3 M prima della reazione dà una concentrazione di equilibrio di I2 di 6,61 × 10−4 M, qual è la costante di equilibrio per la reazione?
Per calcolare le costanti di equilibrio, sono necessarie concentrazioni di equilibrio per tutti i reagenti e i prodotti:
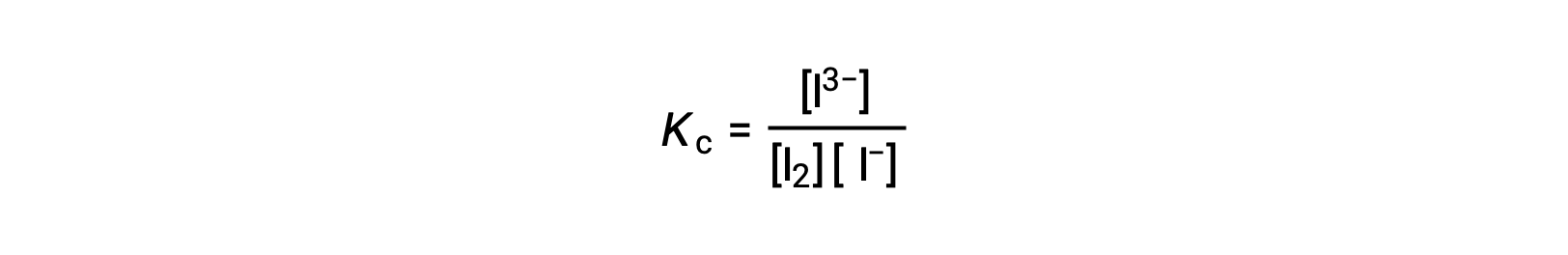
Vengono fornite le concentrazioni iniziali dei reagenti e la concentrazione di equilibrio del prodotto. Queste informazioni possono essere utilizzate per ricavare termini per le concentrazioni di equilibrio dei reagenti, presentando tutte le informazioni in una tabella ICE.
| I2 (aq) | I− (aq) | I3− (aq) | |
| Concentrazione iniziale (M) | 1.000 × 10−3 | 1.000 × 10−3 | 0 |
| Variazione (M) | −x | −x | +x |
| Concentrazione di equilibrio (M) | 1.000 × 10−3 − x | 1.000 × 10-3 − x | X |
All’equilibrio la concentrazione di I2 è di 6,61 × 10−4 M in modo che
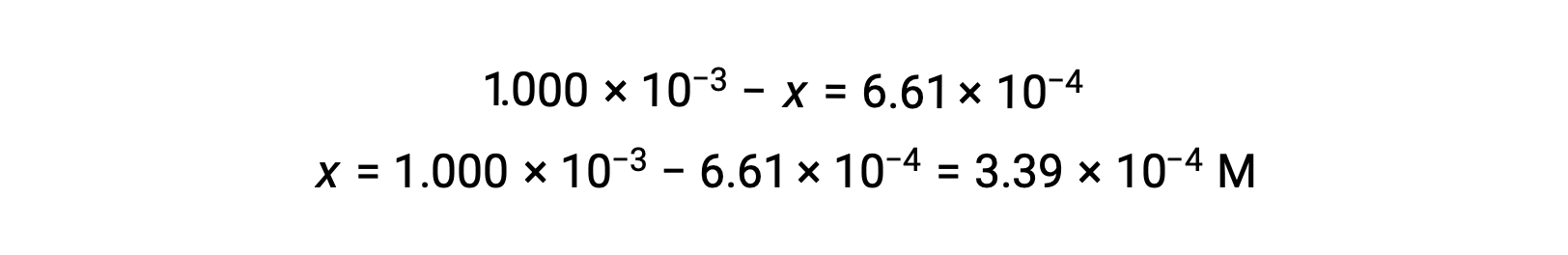
La tabella ICE può ora essere aggiornata con valori numerici per tutte le sue concentrazioni:
| I2 (aq) | I− (aq) | I3− (aq) | |
| Concentrazione iniziale (M) | 1.000 × 10−3 | 1.000 × 10−3 | 0 |
| Variazione (M) | -3,39 × 10-4 | -3,39 × 10-4 | +3,39 × 10-4 |
| Concentrazione di equilibrio (M) | 6,61 × 10-4 | 6,61 × 10-4 | 3,39 × 10-4 |
Infine, le concentrazioni di equilibrio possono essere sostituite nell’espressione Kc e risolte:
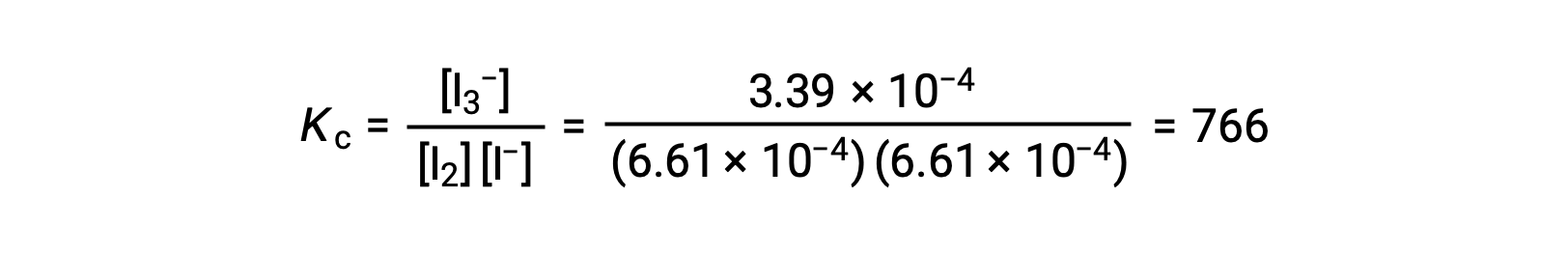
Questo testo è stato adattato da Openstax, Chimica 2e, Sezione 13.4 Calcoli di equilibrio.
