14.6:
Calculando las Concentraciones en Equilibrio
14.6:
Calculando las Concentraciones en Equilibrio
La capacidad de calcular las concentraciones en equilibrio es esencial para muchas áreas de la ciencia y la tecnología, por ejemplo, en la formulación y dosificación de productos farmacéuticos. Después de ingerir o inyectar un fármaco, típicamente este se involucra en varios equilibrios químicos que afectan su concentración final en el sistema corporal de interés. Se requiere conocimiento de los aspectos cuantitativos de estos equilibrios para calcular una dosis que brinde el efecto terapéutico deseado.
Un tipo de cálculo de equilibrio más difícil puede ser aquel en el que las concentraciones en equilibrio se derivan de las concentraciones iniciales y de una constante de equilibrio. Para estos cálculos, puede ser útil un enfoque de cuatro pasos:
- Identifique la dirección en la que la reacción procederá para alcanzar el equilibrio.
- Desarrolle una tabla ICE.
- Calcule los cambios de concentración y, posteriormente, las concentraciones en equilibrio.
- Confirme las concentraciones en equilibrio calculadas.
Cálculo de las concentraciones en equilibrio
En determinadas condiciones, la constante de equilibrio Kc para la descomposición de PCL5(g) en PCl3(g) y Cl2(g) es de 0,0211. El procedimiento anterior puede utilizarse para determinar las concentraciones en equilibrio de PCL5, PCl3 y Cl2 en una mezcla que inicialmente contenía sólo PCL a una concentración de 1,00 M.
Paso 1.Determine la dirección en la que procede la reacción.
La ecuación balanceada para la descomposición de PCL5 es
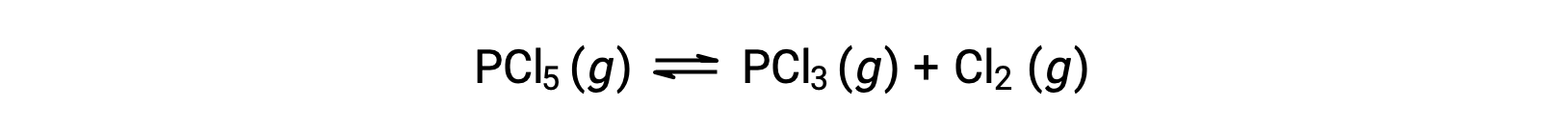
Dado que al principio sólo está presente el reactivo, Qc = 0 y la reacción procederá hacia la derecha.
Paso 2. Desarrolle una tabla ICE.
| PCL5 g) | PCL3g) | Cl2g) | |
| Concentración inicial (M) | 1,00 | 0 | 0 |
| Cambio (M) | −x | +x | +x |
| Concentración en equilibrio (M) | 1,00 − x | x | x |
Paso 3.Resuelva para hallar el cambio de concentración y las concentraciones en equilibrio.
La sustitución de las concentraciones en equilibrio en la ecuación de la constante de equilibrio da
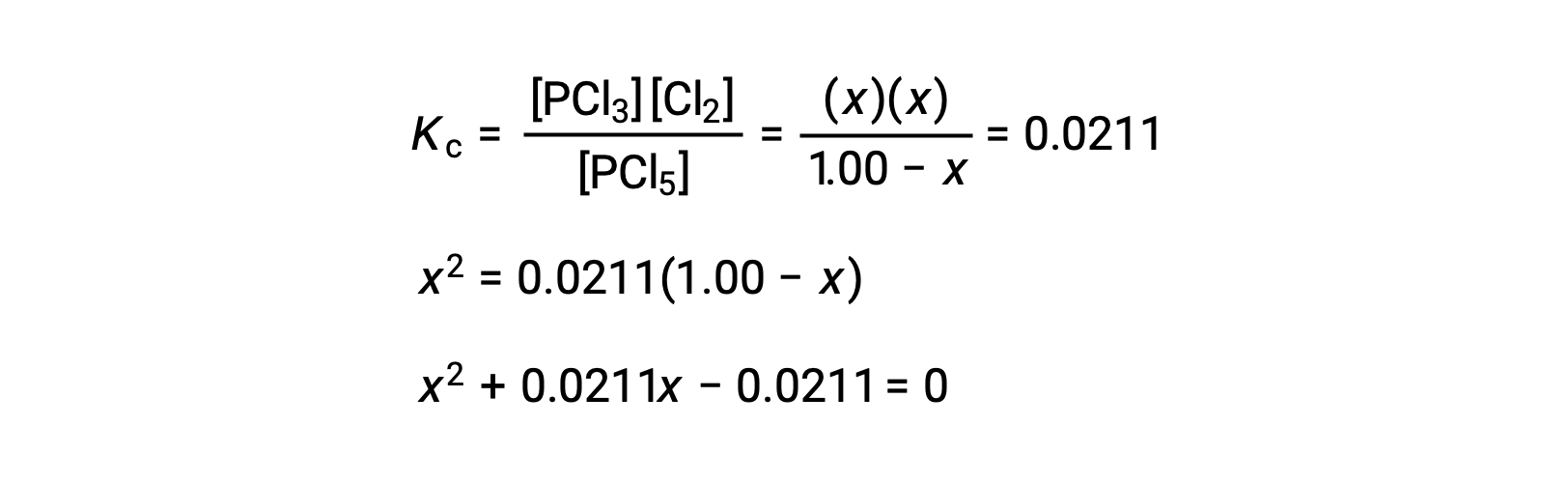
Una ecuación de la forma ax2 + bx + c = 0 puede ser reorganizada para hallar el valor de x:
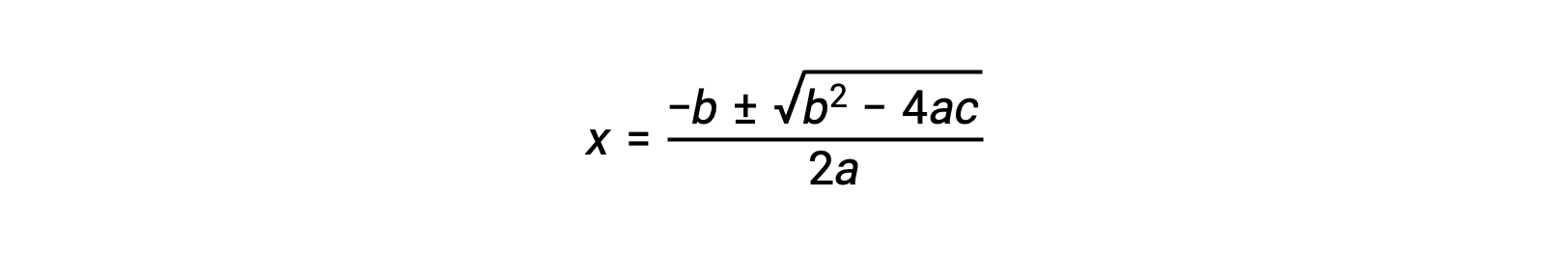
En este caso, a = 1, b = 0,0211 y c = −0,0211. Si se sustituyen los valores adecuados para a, b y c, se produce:
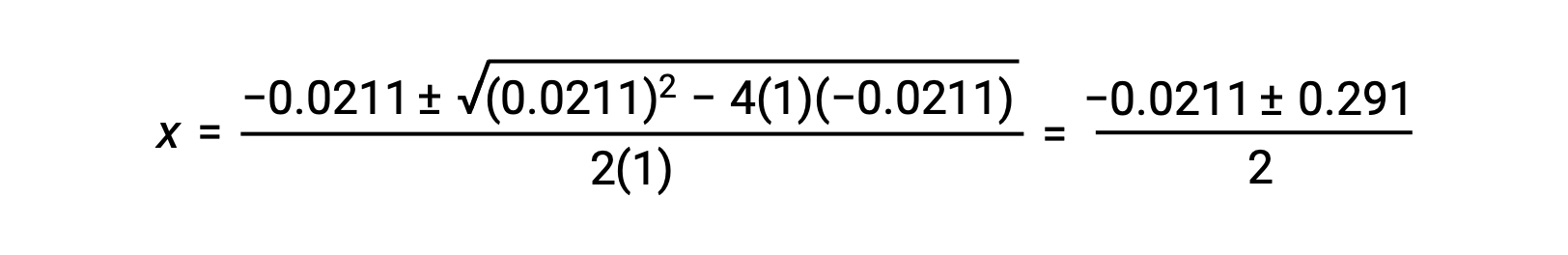
Las dos raíces cuadradas son, por lo tanto,
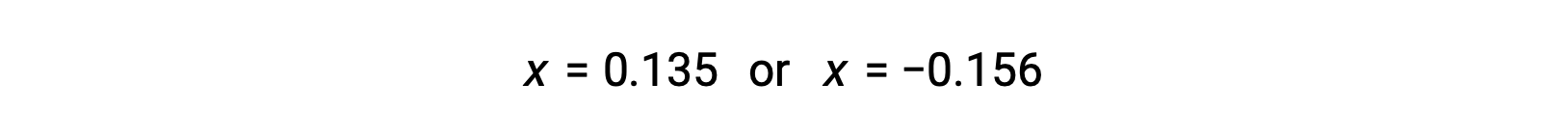
Para este escenario, sólo la raíz positiva es físicamente significativa (las concentraciones son cero o positivas), y así x = 0,135 M. Las concentraciones en equilibrio son
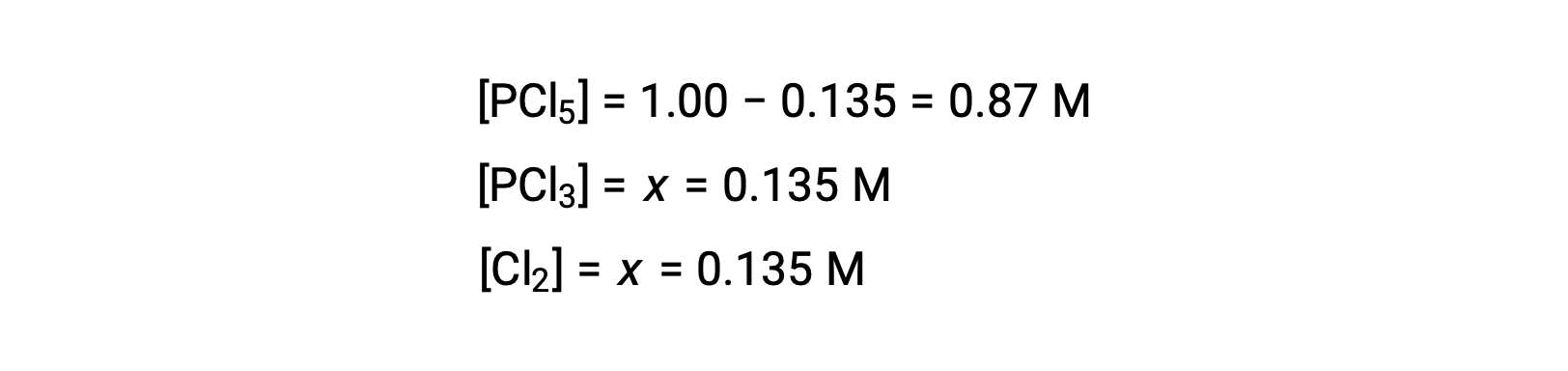
Paso 4.Confirme las concentraciones en equilibrio calculadas.
La sustitución de Kc en la expresión (para verificar el cálculo) da
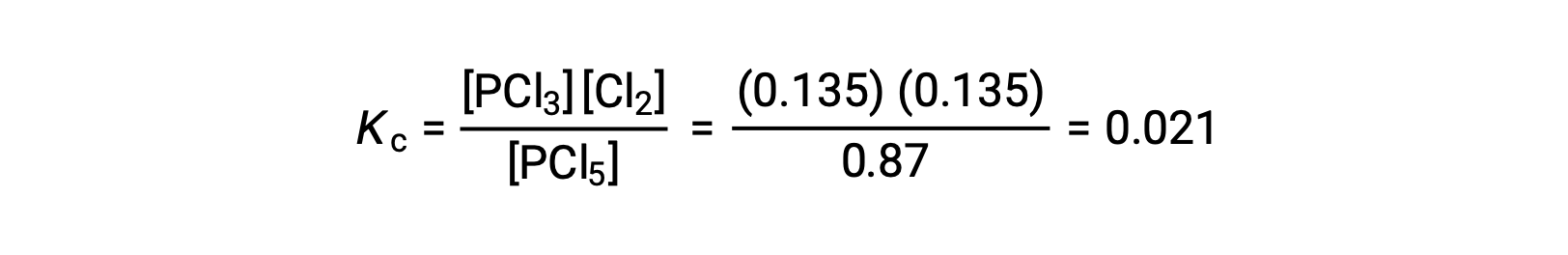
La constante de equilibrio calculada a partir de las concentraciones en equilibrio es igual al valor de Kc indicado en el problema (cuando se redondea al número adecuado de cifras significativas).
Este texto ha sido adaptado de Openstax, Química 2e, Sección 13.4 Cálculos de Equilibrio.
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs.acs.org/doi/pdf/10.1021/ed085p1347
