14.6:
平衡濃度の計算
14.6:
平衡濃度の計算
平衡濃度を計算することは、科学技術の多くの分野で不可欠です。例えば、医薬品の処方や投与においても同様です。医薬品は、摂取または注射された後、対象となる体内の最終的な濃度に影響を与えるいくつかの化学平衡に関与しています。望ましい治療効果を得るための投与量を計算するには、これらの平衡の定量的な側面に関する知識が必要です。
より困難とされる平衡計算は、初期濃度と平衡定数から平衡濃度を導き出すものです。このような計算では、一般的に4つのステップのアプローチが有効です。
- 平衡に達するまでの反応の進行方向を明らかにする
- ICE表を作成する
- 濃度変化を計算し、続いて平衡濃度を計算する
- 算出された平衡濃度を確認する
平衡状態における濃度の計算
ある条件下で、PCl5(g)をPCl3(g)とCl2(g)に分解する際の平衡定数Kcは0.0211です。上記の手順は、最初に1.00 Mの濃度のPCl5のみを含む混合物中のPCl5、PCl3、およびCl2の平衡濃度を決定するために使用することができます。
Step 1. 反応の進行方向の決定
PCl5の分解の平衡式は、
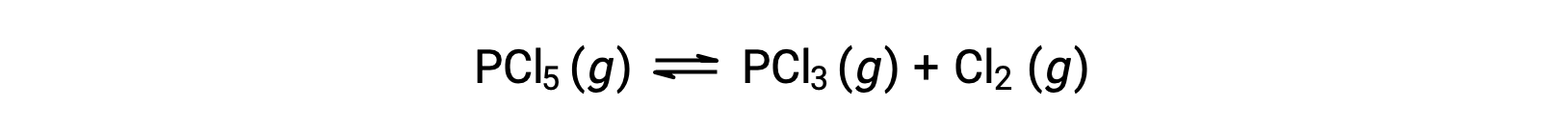
最初は反応物しか存在しないので、Qc = 0となり、反応は右に進む。
Step 2. ICE表の作成
| PCl5 (g) | PCl3 (g) | Cl2 (g) | |
| 初期濃度 (M) | 1.00 | 0 | 0 |
| 濃度変化 (M) | −x | +x | +x |
| 平衡濃度 (M) | 1.00 − x | x | x |
Step 3. 変化量と平衡濃度を解く
平衡定数の式に平衡濃度を代入すると、次のようになります。
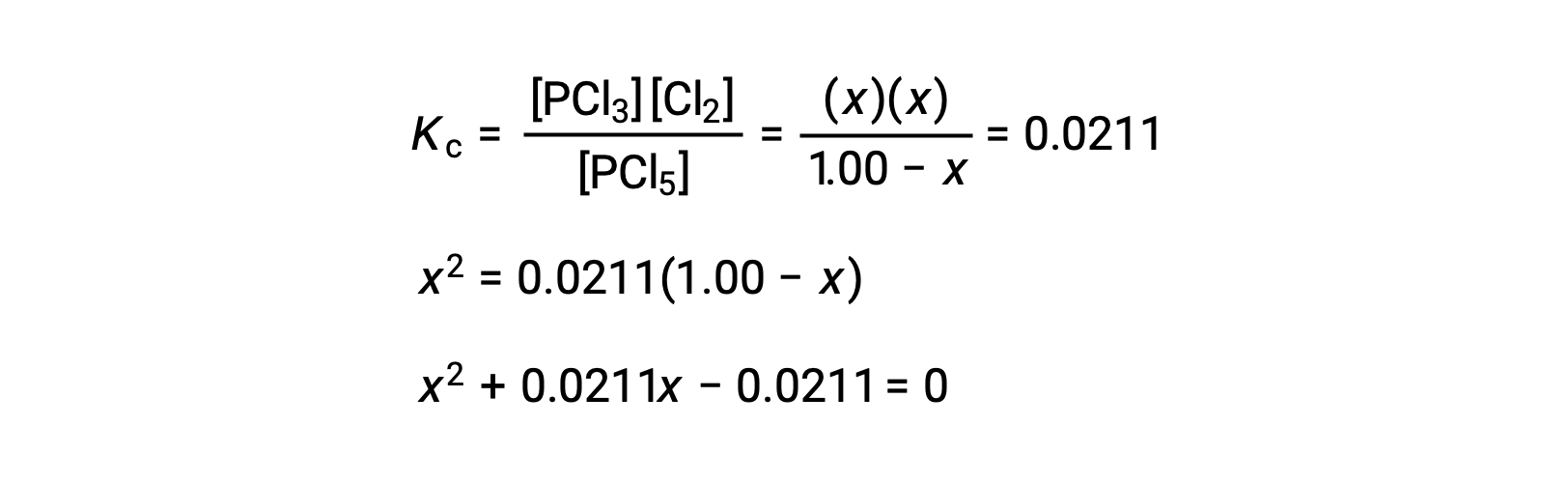
ax2 + bx + c = 0という形の方程式は、xを解くために並べ替えることができます。
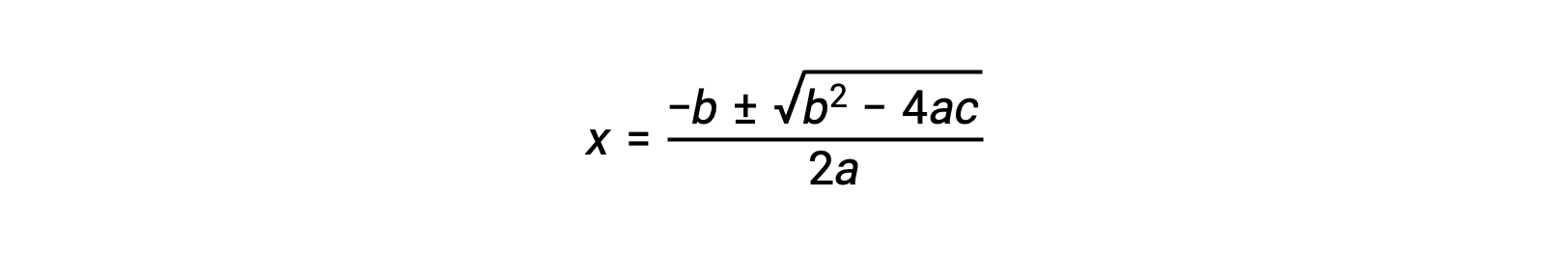
この場合、a = 1、b = 0.0211、c = −0.0211となります。a、b、cに適切な値を代入すると、次のようになります。
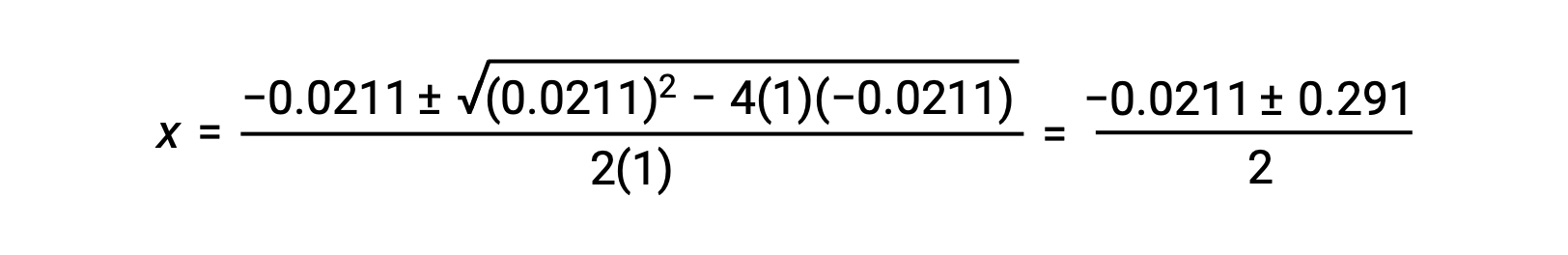
したがって、この二次関数の2つの解は、次のようになります。
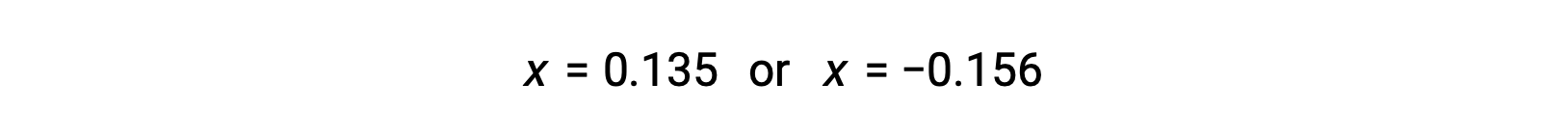
この問題では、解のうち正の値だけが物理的に意味を持つ(濃度はゼロか正のどちらかのため)ので、x = 0.135 Mとなり、平衡濃度は次の通りです。
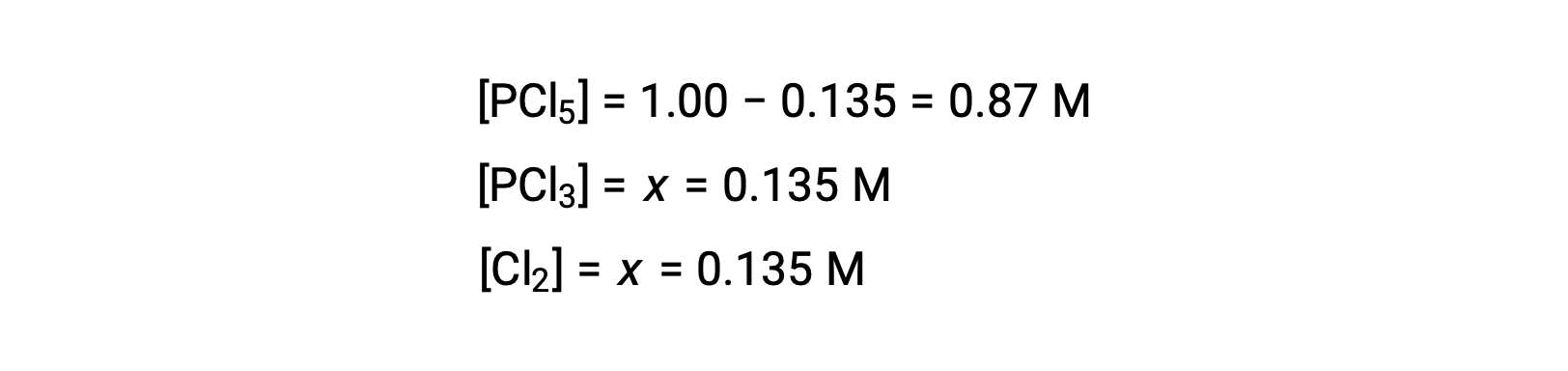
Step 4. 算出された平衡濃度の確認
Substitution into the expression for Kc(to check the calculation) gives
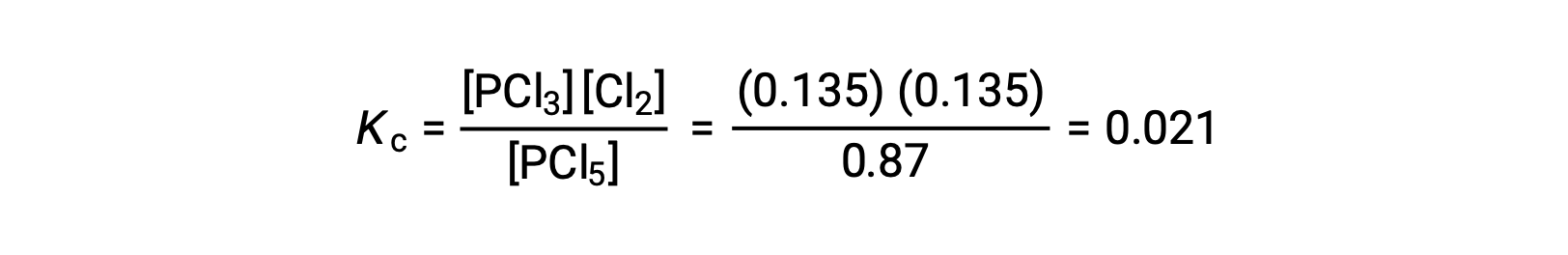
平衡濃度から計算された平衡定数は、問題で与えられたKcの値と等しい(適切な有効数字に丸めた場合)。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 13.4 Equilibrium Calculations.
Suggested Reading
- Lim, Kieran F. "Using graphics calculators and spreadsheets in chemistry: Solving equilibrium problems." Journal of Chemical Education 85, no. 10 (2008): 1347. https://pubs.acs.org/doi/pdf/10.1021/ed085p1347
