14.9:
Принцип ЛеШателье: изменение температуры
14.9:
Принцип ЛеШателье: изменение температуры
В соответствии с законом массового действия, равновесие, напряженное изменением концентрации, будет смещаться, чтобы восстановить равновесие без какого-либо изменения значения константы равновесия, K. когда равновесие смещается в ответ на изменение температуры, однако он вновь устанавливается с другим относительным составом, который показывает другое значение для константы равновесия.
Чтобы понять это явление, рассмотрим элементарную реакцию:
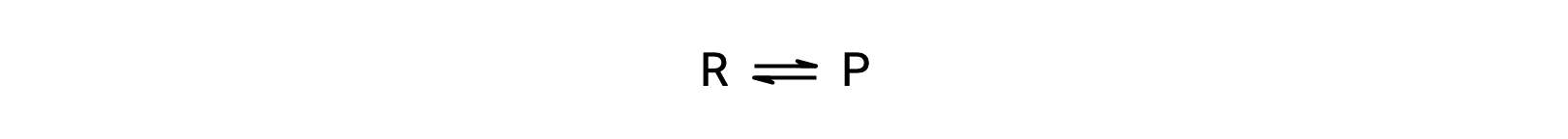
Поскольку это элементарная реакция, законы о ставках для переднего и заднего хода могут быть получены непосредственно из стехиометрии сбалансированного уравнения:
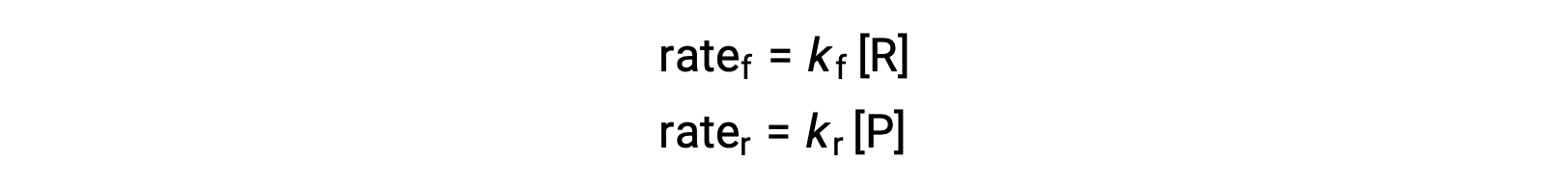
Когда система находится в равновесии,

Подменять законы о процентной ставке на это равенство и перегруппировать их
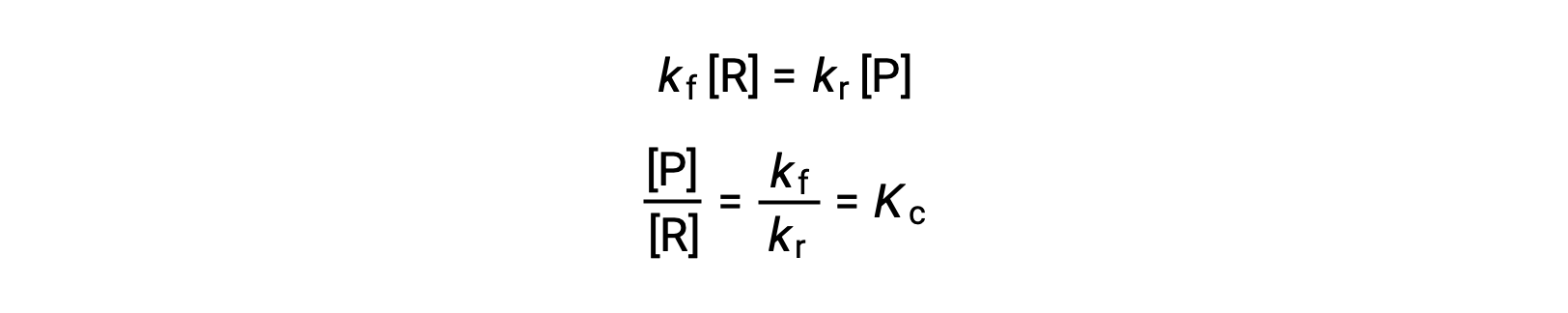
Константа равновесия может быть выражена как математическая функция констант скорости для реакций переднего и заднего хода. Поскольку константы скорости изменяются в зависимости от температуры, как описано в уравнении Аррениуса, следует иметь в виду, что константа равновесия также будет меняться в зависимости от температуры (при условии, что константы скорости изменяются в зависимости от изменения температуры). Для более сложных реакций с участием многоступенчатых механизмов реакции существует аналогичное, но более сложное математическое соотношение между константой равновесия и константами скорости шагов в механизме. Независимо от того, насколько сложной может быть реакция, температурная зависимость ее равновесной константы сохраняется.
Предсказание сдвига равновесие будет ощущаться в ответ на изменение температуры наиболее удобным путем с учетом изменения энтальпии реакции. Например, образование аммиака в процессе Хабрера является экзотермическим (теплопроизводящим) процессом:
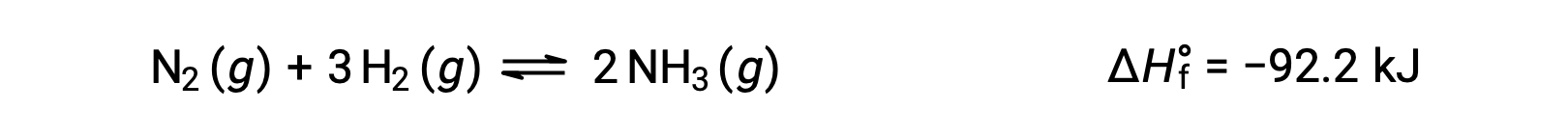
В целях применения принципа Ле Шатье тепло, q, можно рассматривать как продукт:
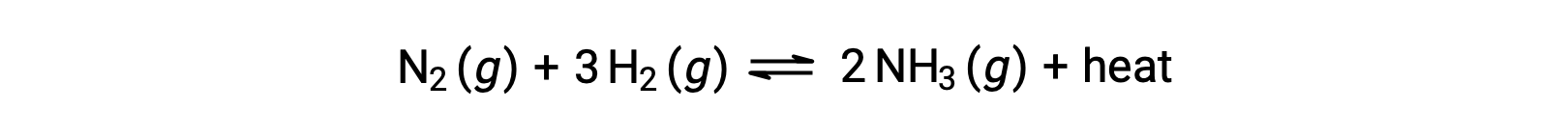
Повышение температуры системы сродни увеличению количества продукта, поэтому равновесие будет смещаться влево. Снижение температуры в системе также приведет к смещению равновесия вправо. Для эндотермических процессов тепло рассматривается как реагент реакции и поэтому наблюдается противоположная температурная зависимость.
Этот текст был адаптирован к Openstax, Химия 2е изд., раздел 13.3 Сдвигающее равновесие: Принцип Ле Шателье.
