14.9:
مبدأ لوشاتيليير: تغيير درجة الحرارة
14.9:
مبدأ لوشاتيليير: تغيير درجة الحرارة
بما يتوافق مع قانون الحركة الجماعية ، فإن التوازن الذي يؤكده تغيير التركيز سوف يتحول إلى إعادة التوازن دون أي تغيير في قيمة ثابت التوازن ، K. عند حدوث توازن التحولات استجابة لتغير في درجة الحرارة ، ومع ذلك ، يتم إعادة إنشائها بتكوين نسبي مختلف يعرض قيمة مختلفة لثابت التوازن.
لفهم هذه الظاهرة ، ضع في اعتبارك التفاعل الأولي:
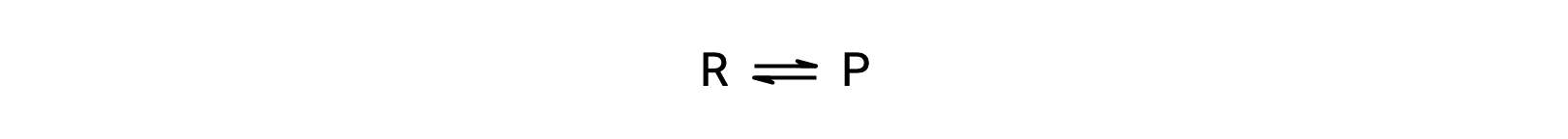
نظرًا لأن هذا رد فعل أولي ، يمكن اشتقاق قوانين المعدلات للأمام والعكس مباشرة من القياس المتكافئ للمعادلة المتوازنة:
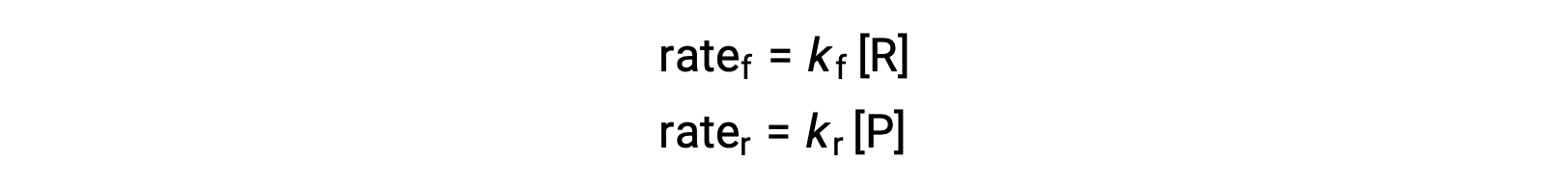
عندما يكون النظام في حالة توازن ،

استبدال قوانين المعدلات في هذه المساواة وإعادة الترتيب يعطي
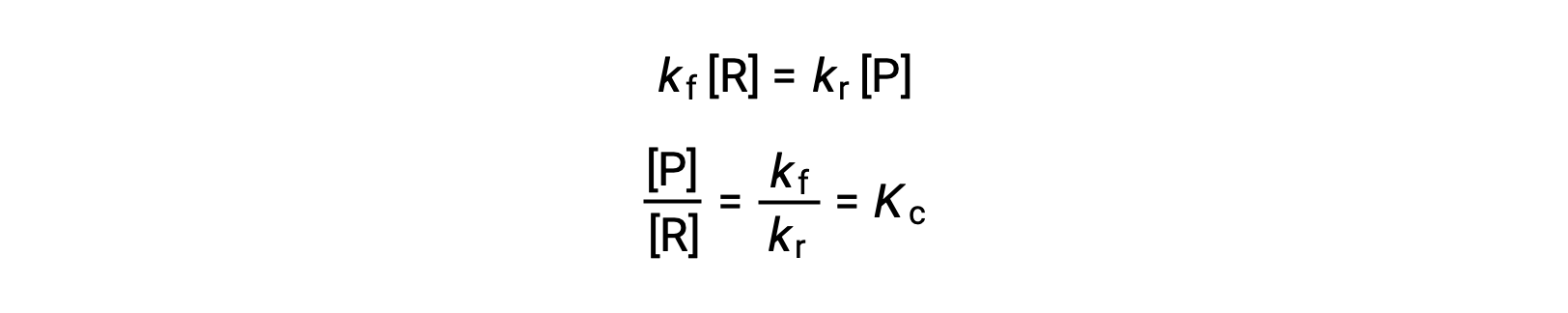
يمكن التعبير عن ثابت التوازن كدالة رياضية لثوابت المعدل للتفاعلات الأمامية والعكسية. نظرًا لأن ثوابت المعدل تختلف باختلاف درجة الحرارة كما هو موضح في معادلة أرهينيو ، فمن المنطقي أن ثابت التوازن سيتغير بالمثل مع درجة الحرارة (بافتراض أن ثوابت المعدل تتأثر بدرجات مختلفة بتغير درجة الحرارة). بالنسبة للتفاعلات الأكثر تعقيدًا التي تتضمن آليات تفاعل متعددة الخطوات، توجد علاقة رياضية مماثلة ولكنها أكثر تعقيدًا بين ثابت التوازن وثوابت معدل الخطوات في الآلية. بغض النظر عن مدى تعقيد التفاعل، يستمر الاعتماد على درجة الحرارة في ثابت التوازن الخاص به.
إن توقع التحول الذي سيشهده التوازن استجابةً لتغير في درجة الحرارة هو الأكثر ملاءمةً من خلال النظر في تغير المحتوى الحراري للتفاعل. على سبيل المثال، يعتبر تكوين الأمونيا بواسطة عملية هابر’ عملية طاردة للحرارة (منتجة للحرارة):
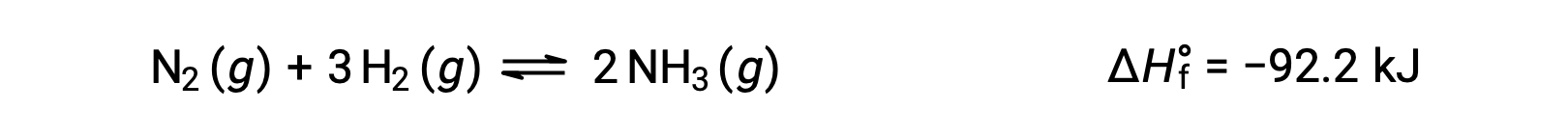
لأغراض تطبيق مبدأ âلو شاتيلير#8217; يمكن اعتبار الحرارة ، q ، على أنها منتج:
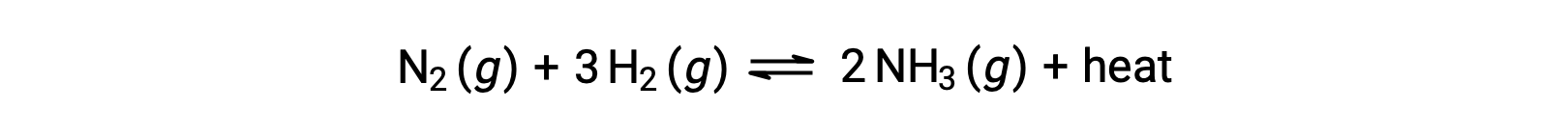
يشبه رفع درجة حرارة النظام زيادة كمية المنتج، وبالتالي سيتحول التوازن إلى اليسار. وبالمثل، سيؤدي خفض درجة حرارة النظام إلى تحول التوازن إلى اليمين. بالنسبة للعمليات الماصة للحرارة، يُنظر إلى الحرارة على أنها مادة متفاعلة للتفاعل ولذلك يتم ملاحظة الاعتماد المعاكس لدرجة الحرارة.
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: Le Châtelier’s Principle.
