14.9:
Principio di LeChatelier: cambiare la temperatura
14.9:
Principio di LeChatelier: cambiare la temperatura
Coerentemente con la legge dell’azione di massa, un equilibrio sottolineato da un cambiamento di concentrazione si sposterà per ristabilire l’equilibrio senza alcun cambiamento nel valore della costante di equilibrio, K. Quando un equilibrio si sposta in risposta a un cambiamento di temperatura, tuttavia, viene ri stabilito con una composizione relativa diversa che mostra un valore diverso per la costante di equilibrio.
Per comprendere questo fenomeno, considera la reazione elementare:
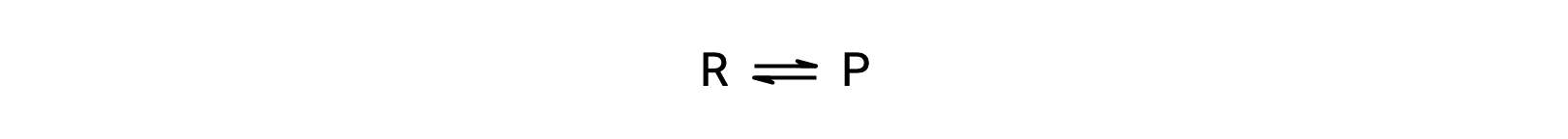
Poiché questa è una reazione elementare, le leggi sui tassi per il avanti e il rovescio possono essere derivate direttamente dalla stechiometria dell’equazione bilanciata:
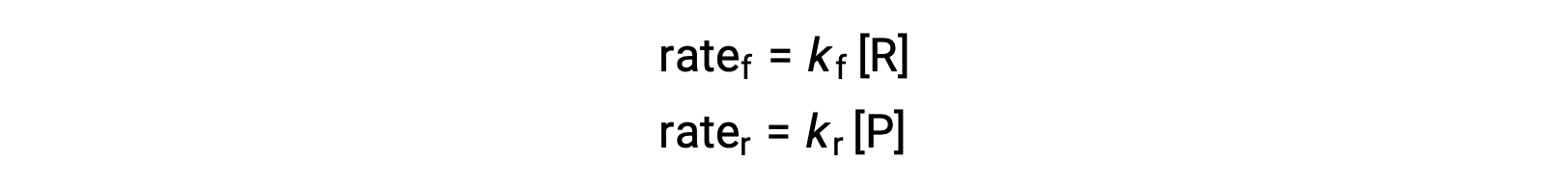
Quando il sistema è in equilibrio,

Sostituendo le leggi sui tassi in questa uguaglianza e riorganizzando si ottiene
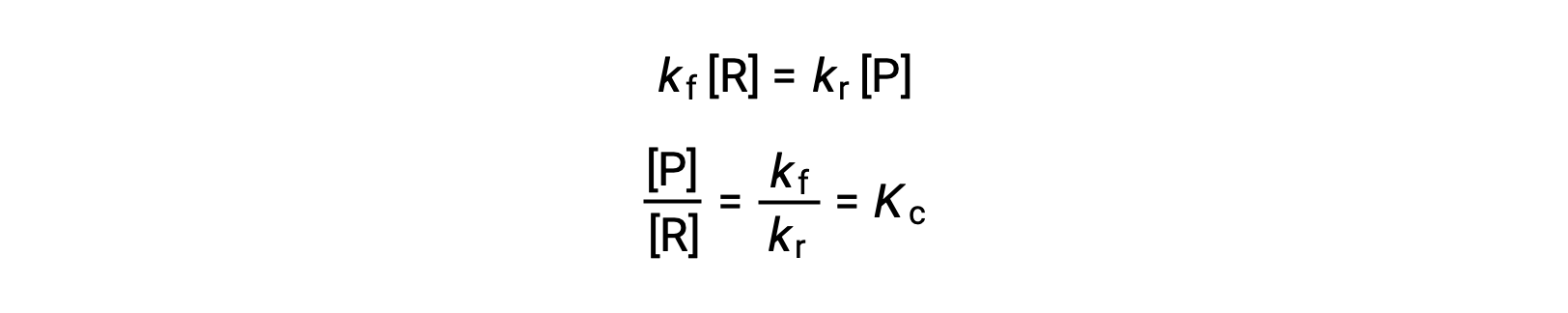
La costante di equilibrio può essere espressa come una funzione matematica delle costanti di velocità per le reazioni avanti e indietro. Poiché le costanti di velocità variano con la temperatura descritta dall’equazione di Arrhenius, è ovvio che anche la costante di equilibrio varierà con la temperatura (supponendo che le costanti di velocità siano influenzate in misura diversa dal cambiamento di temperatura). Per reazioni più complesse che coinvolgono meccanismi di reazione multistep, esiste una relazione matematica simile ma più complessa tra la costante di equilibrio e le costanti di velocità dei passi nel meccanismo. Indipendentemente da quanto complessa possa essere la reazione, persiste la dipendenza dalla temperatura della sua costante di equilibrio.
Prevedere lo spostamento che un equilibrio sperimenterà in risposta ad un cambiamento di temperatura è più convenientemente realizzato considerando il cambiamento di entalpia della reazione. Ad esempio, la formazione di ammoniaca mediante il processo di Haber è un processo esotermico (che produce calore):
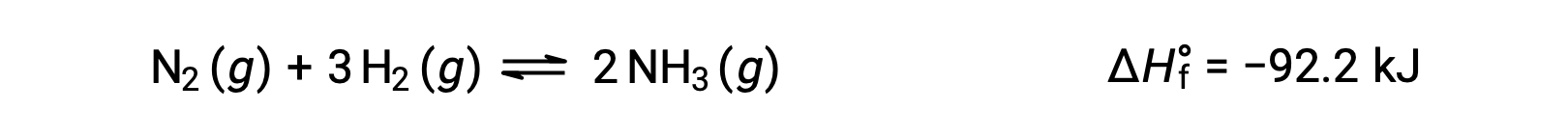
Ai fini dell’applicazione del principio di Le Châtelier, il calore, q, può essere visto come un prodotto:
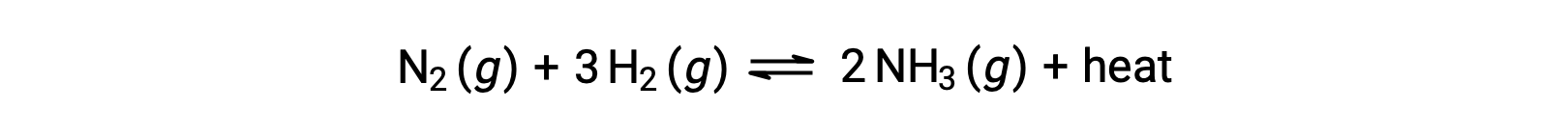
Aumentare la temperatura del sistema è simile ad aumentare la quantità di un prodotto, e quindi l’equilibrio si sposterà a sinistra. L’abbassamento della temperatura del sistema farà sì che l’equilibrio si sposti a destra. Per i processi endotermici, il calore è visto come un reagente della reazione e quindi si osserva la dipendenza dalla temperatura opposta.
Questo testo è stato adattato da Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: Le Châtelier’s Principle.
