15.2:
酸/塩基強度及び解離定数
15.2:
酸/塩基強度及び解離定数
酸や塩基の相対的な強さとは、水に溶解させた際のイオン化の度合いのことです。イオン化反応がほとんど完全に進行する場合、それらは強酸や強塩基と呼ばれます。一方、イオン化がほとんど起こらない場合、それらは弱酸や弱塩基と呼ばれます。弱酸・弱塩基は強酸・強塩基よりも多く存在します。代表的な強酸・強塩基は下記の通りです。
| 強酸 | 強塩基 |
| HClO4 | LiOH |
| HCl | NaOH |
| HBr | KOH |
| HI | Ca(OH)2 |
| HNO3 | Sr(OH)2 |
| H2SO4 | Ba(OH)2 |
酸の相対的な強さは、水溶液中の平衡定数を解析することで定量化できます。同じ濃度の水溶液中では、強酸は弱酸よりもよりイオン化しており、高濃度のヒドロニウムイオンを生成します。酸の平衡定数を酸解離定数Kaといいます。酸HAの反応に対して:
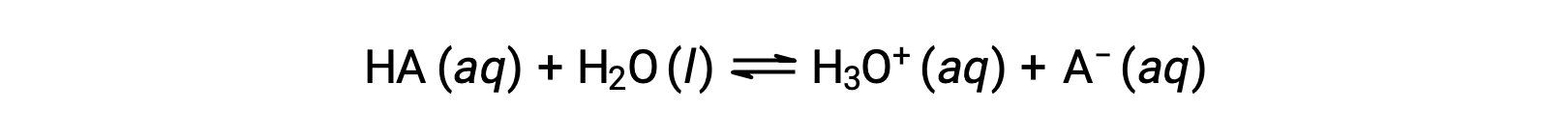
酸解離定数は下記のように表されます。
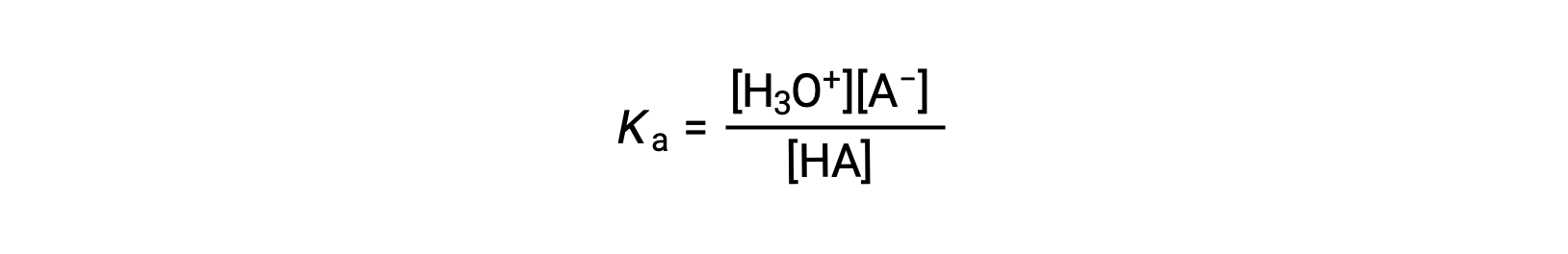
ここで、濃度は平衡状態のものを指します。水は反応の反応物ですが、溶媒でもあるので、[H2O]は式に含めません。酸のKaが大きいほど、平衡混合物中の非電離酸であるHAの濃度に対して、H3O+とA−の濃度が大きくなり、酸が強くなります。酸が完全に電離した場合にはHAの濃度はゼロとなり、酸解離定数は計り知れないほど大きくなる(Ka ≈ ∞)ため、「強酸」と分類されます。部分的に電離している酸は「弱酸」と呼ばれ、その酸解離定数は実験的に測定することができます。
この考えを説明するために、3つの酸のイオン化式とKaの値を以下に示します。解離定数は列挙された式の下側に向かって増加しており、CH3CO2H < HNO2 < HSO4−の順に相対的な酸の強さが増加することを示しています。
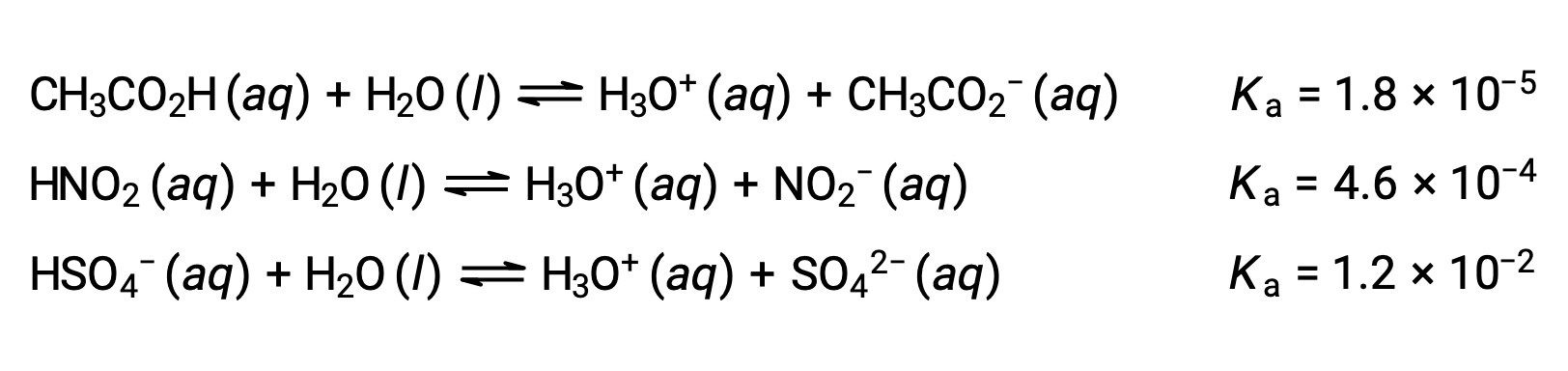
酸の強さを表すもう一つの指標は、そのイオン化率です。弱酸のイオン化率は、平衡混合物の組成に基づいて定義されます。
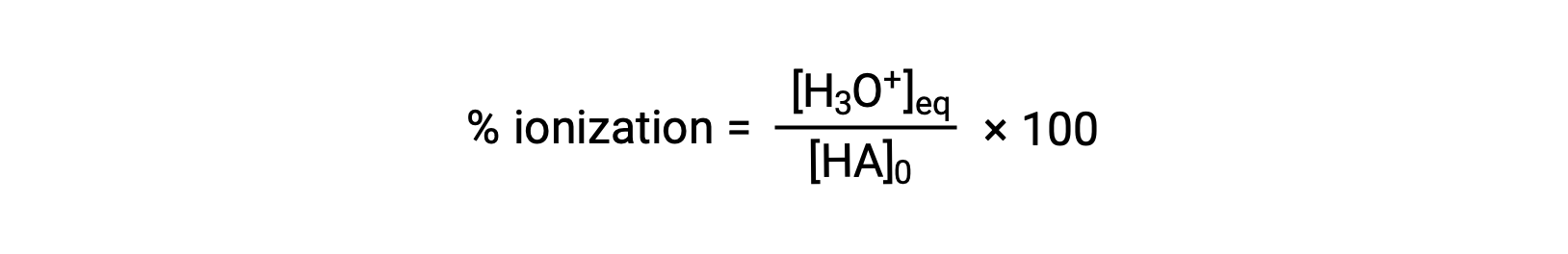
ここで、分子の濃度は酸の共役塩基の濃度に相当する(化学量論的には、[A−] = [H3O+])。弱酸性のイオン化率はKa値と異なり、酸の初期濃度に応じて変化し、一般的には濃度が高くなるにつれて減少します。
酸の場合と同様に、塩基の相対的な強さは、水溶液中の塩基解離定数(Kb)の大きさに反映されます。同じ濃度の水溶液では、強塩基は弱塩基よりも大きな割合でイオン化し、水酸化物イオンの濃度が高くなります。強塩基は、弱塩基よりも解離定数が大きいです。塩基Bの反応について:
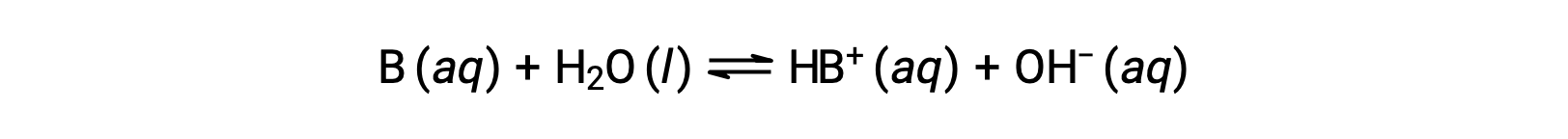
解離定数は下記のように表されます。
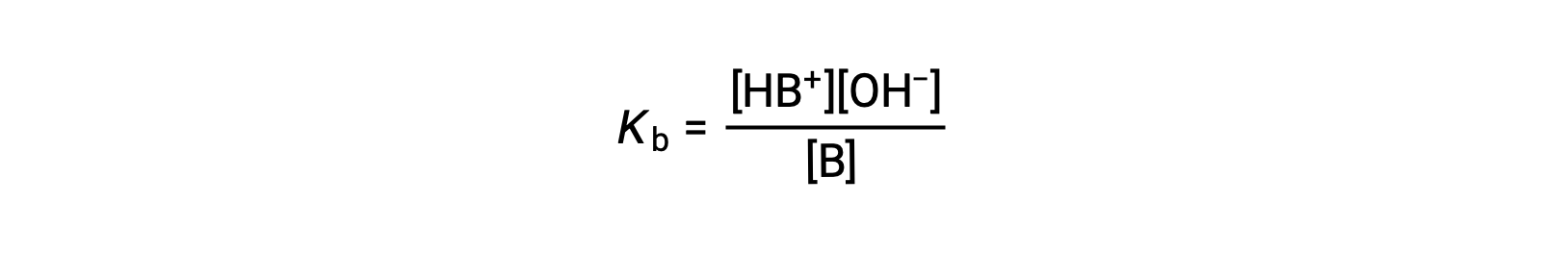
以下に示す3つの弱塩基のイオン化式を見ると、NO2− < CH2 CO2− < NH3の順に塩基強度が増加することがわかります。
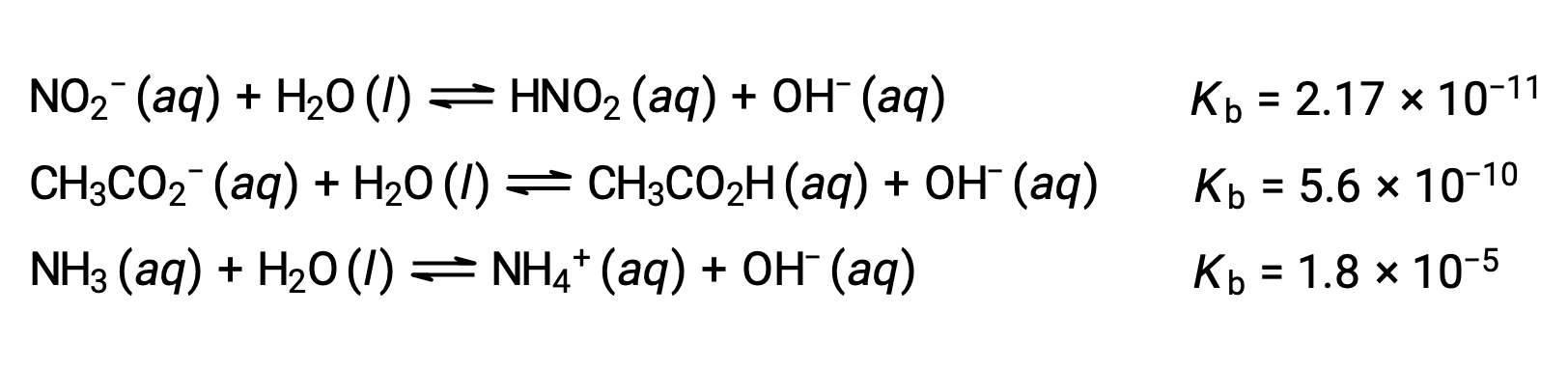
酸と同様に、塩基の相対的な強さはイオン化率に反映されます。イオン化率の計算式は次の通りです。
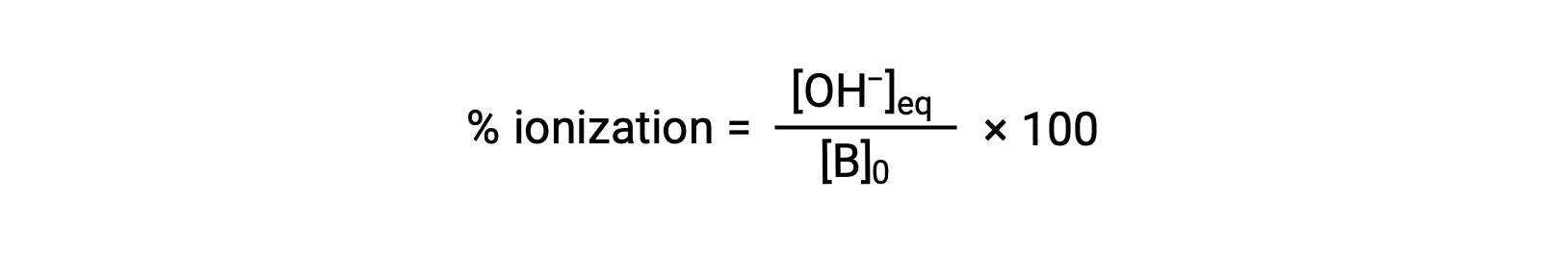
この値は、塩基解離定数や溶液の初期濃度によって変化します。
上記の文章は以下から引用しました。 Openstax, Chemistry 2e, Section 14.3: Relative Strengths of Acids and Bases.
