15.2:
Fuerzas de Ácidos/Bases y Constantes de Disociación
15.2:
Fuerzas de Ácidos/Bases y Constantes de Disociación
La fuerza relativa de un ácido o una base es el grado en que este se ioniza cuando se disuelve en agua. Si la reacción de ionización es esencialmente completa, el ácido o la base se denomina fuerte; si ocurre relativamente poca ionización, el ácido o la base es débil. Hay muchos más ácidos y bases débiles que fuertes. A continuación se enumeran los ácidos y bases fuertes más comunes:
| Ácidos fuertes | Bases fuertes |
| HClO4 | LiOH |
| HCl | NaOH |
| HBr | KOH |
| HI | CA(OH)2 |
| HNO3 | Sr(OH)2 |
| H 2SO4 | Ba(OH)2 |
Las fuerzas relativas de los ácidos pueden cuantificarse midiendo sus constantes de equilibrio en soluciones acuosas. En soluciones de la misma concentración, los ácidos más fuertes ionizan en mayor medida y por lo tanto producen concentraciones más altas de iones de hidronio que los ácidos más débiles. La constante de equilibrio para un ácido se llama constante de ionización ácida, Ka. Para la reacción de un ácido HA:
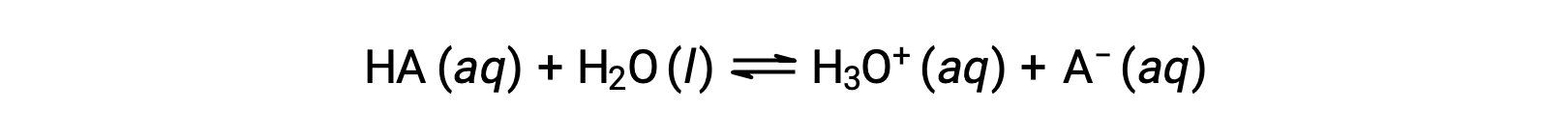
la constante de ionización ácida se escribe como
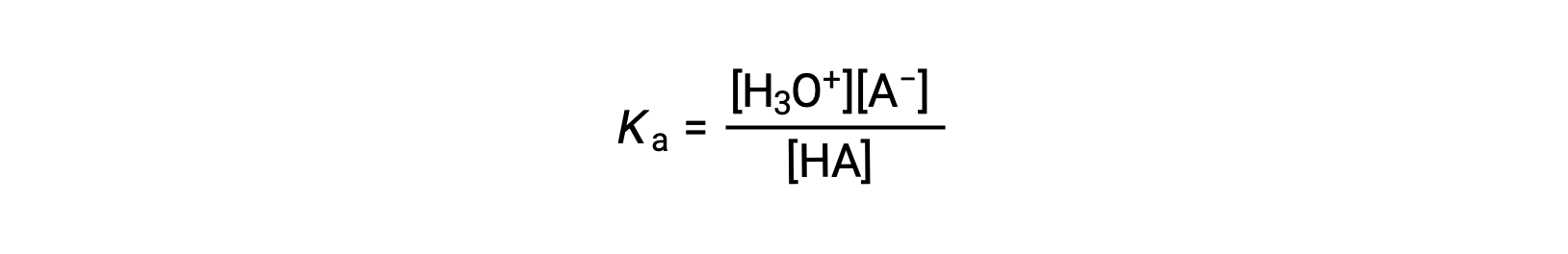
donde las concentraciones son aquellas que están en equilibrio. Aunque el agua es un reactivo en la reacción, también es el solvente, por lo que no incluimos [H2O] en la ecuación. Cuanto mayor sea el Ka de un ácido, mayor será la concentración de H3O+ y A− en relación con la concentración del ácido no ionizado, HA, en una mezcla en equilibrio, y más fuerte será el ácido. Un ácido se clasifica como “fuerte” cuando sufre una ionización completa, en cuyo caso la concentración de HA es cero y la constante de ionización ácida es inmensurablemente grande (Ka ≈ ∞). Los ácidos parcialmente ionizados se denominan “débiles” y sus constantes de ionización ácida pueden medirse experimentalmente.
Para ilustrar esta idea, a continuación se muestran tres ecuaciones de ionización ácida y valores de Ka. Las constantes de ionización aumentan de la primera a la última de las ecuaciones enumeradas, lo que indica que la fuerza relativa del ácido aumenta en el orden CH3CO2H < HNO2 < HSO4−.
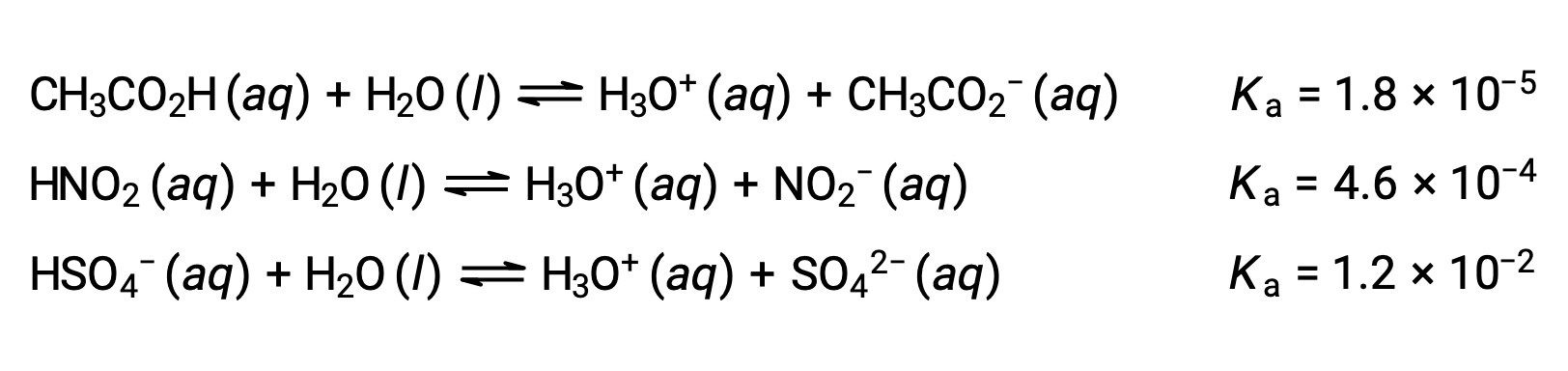
Otra medida de la fuerza de un ácido es su porcentaje de ionización. El porcentaje de ionización de un ácido débil se define en términos de la composición de una mezcla en equilibrio:
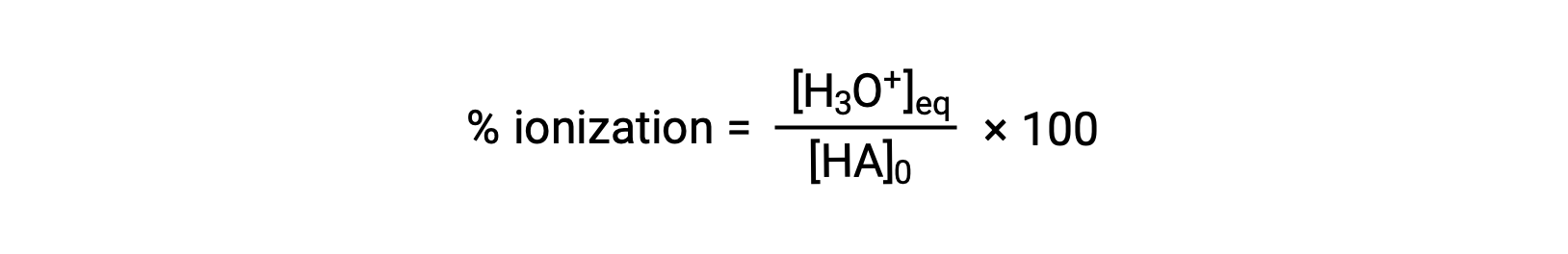
Donde el numerador es equivalente a la concentración de la base conjugada del ácido (por estequiometría, [A−] = [H3O+]). A diferencia del valor Ka, el porcentaje de ionización de un ácido débil varía con la concentración inicial del ácido, normalmente disminuyendo a medida que aumenta la concentración.
Al igual que para los ácidos, la fuerza relativa de una base se refleja en la magnitud de su constante de ionización básica (Kb) en soluciones acuosas. En soluciones de la misma concentración, las bases más fuertes ionizan en mayor medida y, por lo tanto, producen mayores concentraciones de iones de hidróxido que las bases más débiles. Una base más fuerte tiene una constante de ionización más grande que la que tiene una base más débil. Para la reacción de una base, B:
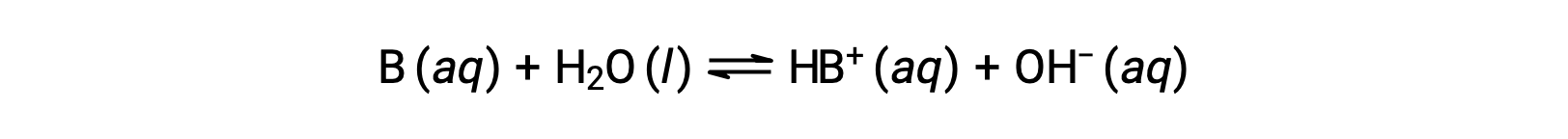
la constante de ionización se escribe como
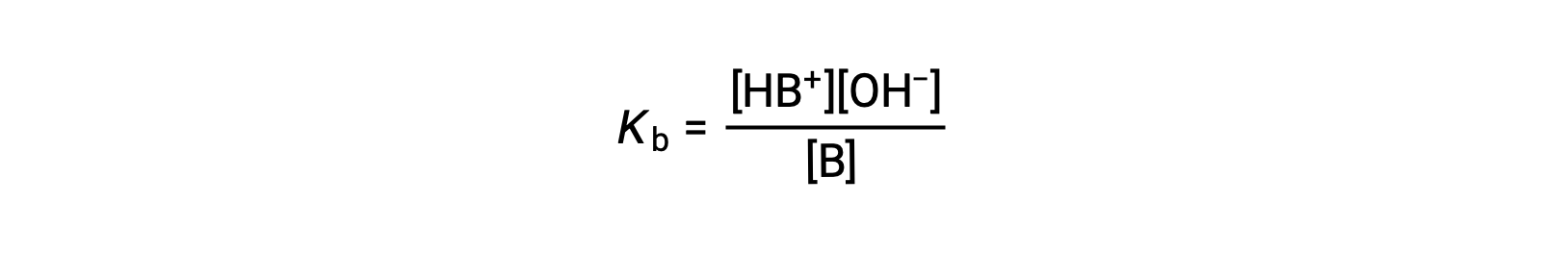
La inspección de los datos de tres bases débiles que se presenta a continuación muestra los aumentos de la fuerza de la base en el orden de NO2− < CH2 CO2− < NH3.
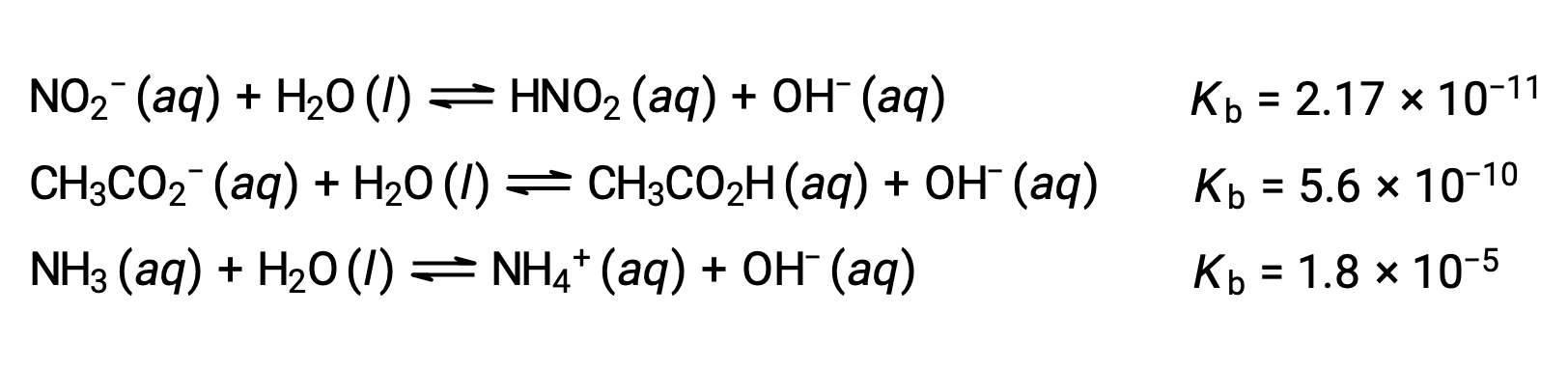
Al igual que para los ácidos, la fuerza relativa de una base también se refleja en su porcentaje de ionización, calculado como
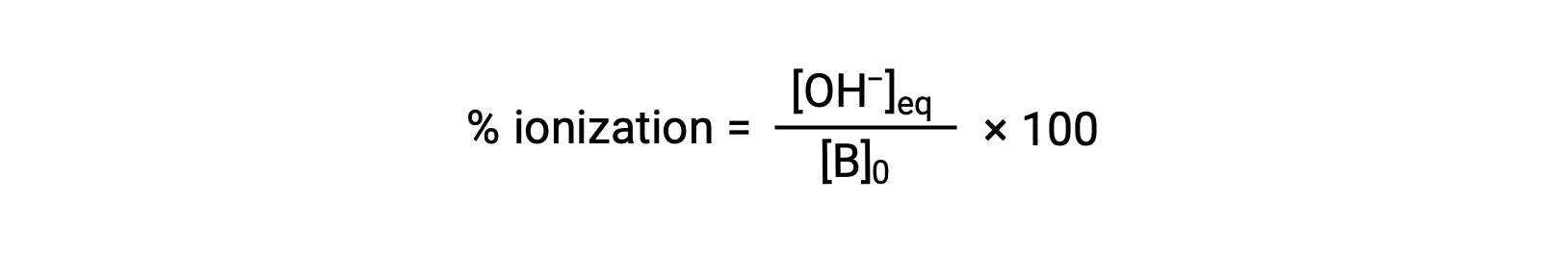
pero variará dependiendo de la constante de ionización básica y de la concentración inicial de la solución.
Este texto es adaptado de Openstax, Química 2e, Sección 14.3: Fuerzas Relativas de Ácidos y Bases.
