15.2:
산/염기 세기와 해리상수
15.2:
산/염기 세기와 해리상수
산 또는 염기의 상대강도는 물에 용해될 때 이온화되는 정도입니다. 이온화 반응이 본질적으로 완료되면 산 또는 염기는 강한 것으로 불려; 비교적 이온화가 거의 발생하지 않으면 산이나 염기가 약합니다. 강한 산보다 더 많은 약한 산과 염분이 있습니다. 가장 일반적인 강한 산과 염기는 다음과 같습니다.
| 강한 산 | 강력한 기지 |
| HClO4 | 리오 (주) |
| Hcl | Naoh |
| HBr | 코 |
| 안녕 | Ca(OH)2 |
| HNO3 | Sr (OH)2 |
| H2SO4 | 바 (OH)2 |
산의 상대적 강점은 수성 솔루션에서 평형 상수를 측정하여 정량화될 수 있다. 동일한 농도의 솔루션에서 강한 산은 이온화되어 약한 산보다 더 높은 농도의 하이드로늄 이온을 얻을 수 있습니다. 산에 대한 평형 상수는 산 이온화 상수, Ka라고한다. 산 하의 반응에 대 한:
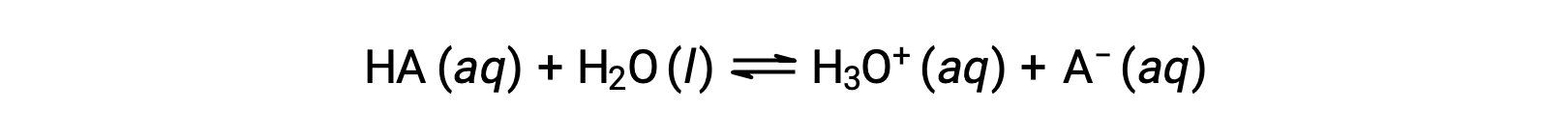
산 이온화 상수는
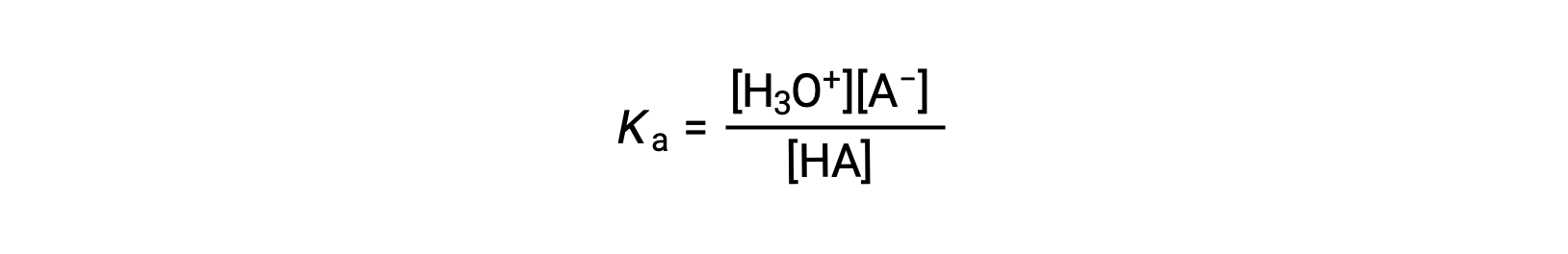
농도는 평형에 있는 사람들입니다. 물은 반응에 반응하지만 용매이므로 방정식에 [H2O]를 포함하지 않습니다. K산의 Ka가 클수록H3O+와 A의 농도가 클수록 – 형평성 혼합물에서, HA, 니온화된 산의 농도에 비해, 하와 산이 강해진다. 산은 완전한 이온화를 거치면 “강한”으로 분류되며, 이 경우 HA의 농도가 0이고 산 이온화 상수는 헤아릴 수 없을 정도로크다(Ka ≈ ∞). 부분적으로 이온화된 산은 “약한”이라고 불리며 산 이온화 상수는 실험적으로 측정될 수 있습니다.
이 아이디어를 설명하기 위해 세 가지 산 이온화 방정식과 K값이 아래에 표시됩니다. 이온화 상수는 나열된 방정식의 첫 번째에서 마지막까지 증가하여 CH3CO2H & HNO2 & HSO4–순서의 상대산 강도 증가를나타냅니다.
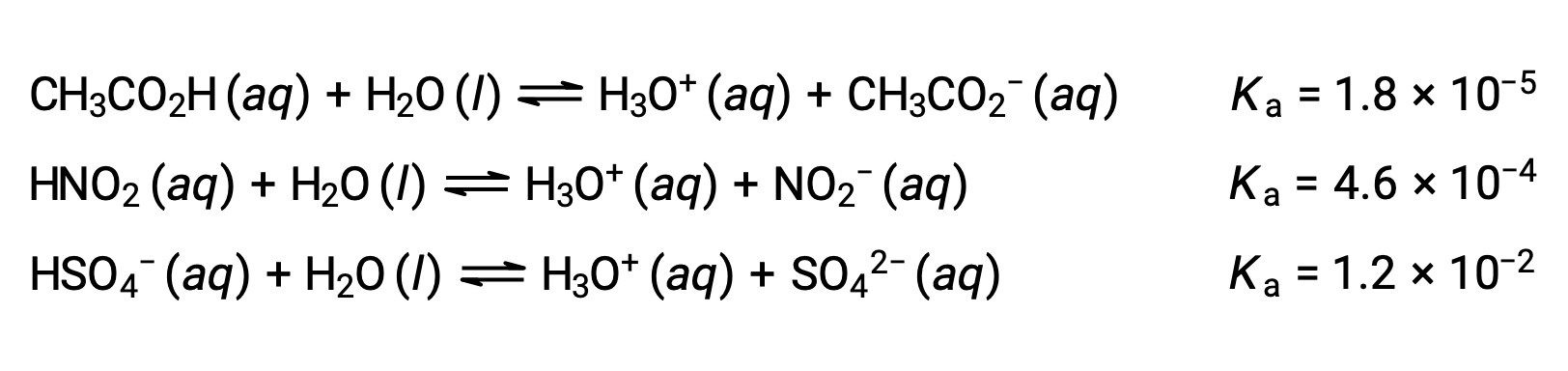
산강도의 또 다른 척도는 백분율 이온화입니다. 약한 산의 백분율 이온화는 평형 혼합물의 조성측면에서 정의됩니다.
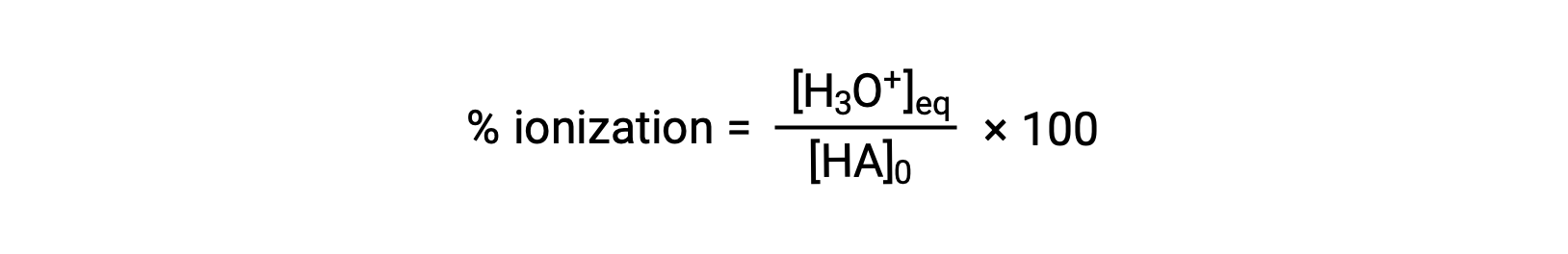
여기서 분자는 산의 컨쥬게이트 베이스의 농도와 동일합니다 (stoichiometry 당, [A−] = [H3O+]). K값과 달리, 약한 산의 백분율 이온화는 산의 초기 농도에 따라 다르며, 일반적으로 농도가 증가함에 따라 감소한다.
산의 경우와 마찬가지로, 염기의 상대강도는 수성 용액에서 기저이온화 상수(Kb)의 크기에 반영된다. 동일한 농도의 솔루션에서, 강한 염기는 더 큰 정도로 이온화, 그래서 약한 기지보다 더 높은 수산화 이온 농도를 산출. 더 강한 베이스는 약한 베이스보다 더 큰 이온화 상수를 가집니다. 기지의 반응에 대 한, B:
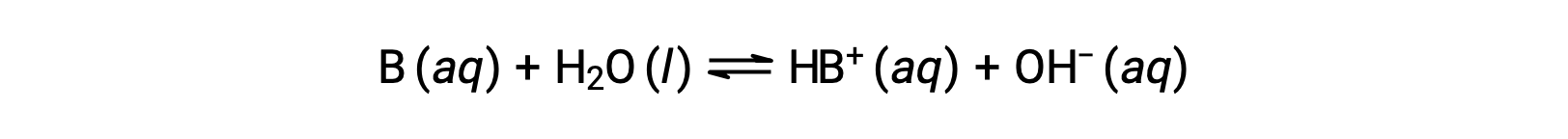
이온화 상수는
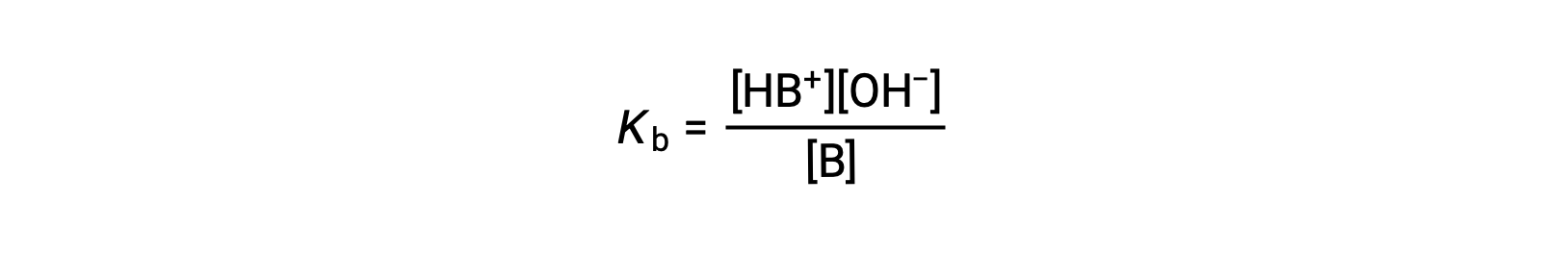
아래에 제시된 3개의 약한 기지에 대한 데이터의 검사는 순서 NO2– & CH2 CO2 – & NH3의기본 강도 증가를 나타낸다.
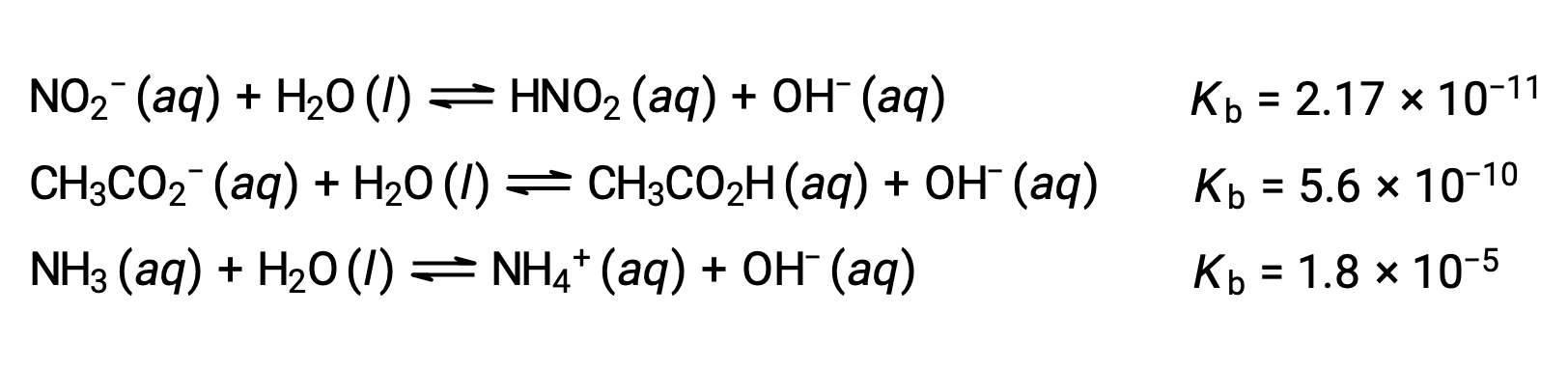
산의 경우, 염기의 상대강도도 백분율 이온화에 반영되며,
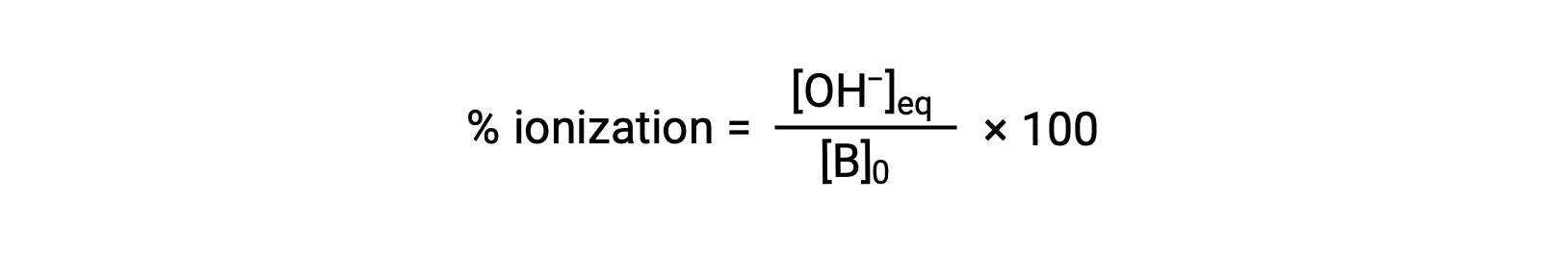
그러나 기본 이온화 상수 및 용액의 초기 농도에 따라 달라집니다.
