15.2:
Forces des acides/bases et constantes de dissociation
15.2:
Forces des acides/bases et constantes de dissociation
La force relative d’un acide ou d’une base est la mesure dans laquelle il s’ionise lorsqu’il est dissous dans l’eau. Si la réaction d’ionisation est essentiellement totale, on dit que l’acide ou la base est fort ; s’il se produit relativement peu d’ionisation, l’acide ou la base est faible. Il y a beaucoup plus d’acides et de bases faibles que de forts. Les acides forts et les bases fortes les plus courants sont énumérés ci-dessous :
| Acides forts | Bases fortes |
| HClO4 | LiOH |
| HCl | NaOH |
| HBr | KOH |
| HI | Ca(OH)2 |
| HNO3 | Sr(OH)2 |
| H2SO4 | Ba(OH)2 |
Les forces relatives des acides peuvent être quantifiées en mesurant leurs constantes d’équilibre dans des solutions aqueuses. Dans des solutions de même concentration, les acides plus forts s’ionisent de façon plus importante et produisent donc des concentrations plus élevées d’ions hydronium que les acides plus faibles. La constante d’équilibre d’un acide est appelée la constante d’ionisation de l’acide, Ka. Pour la réaction d’un acide HA :
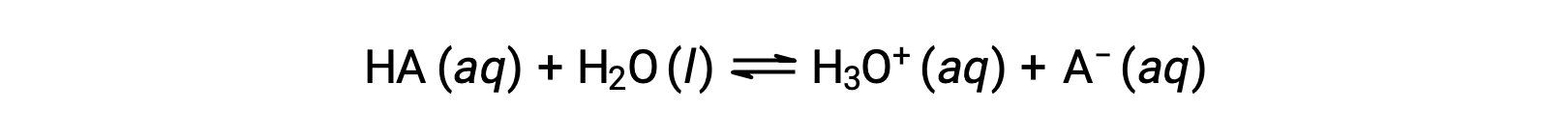
La constante d’ionisation de l’acide est écrite comme
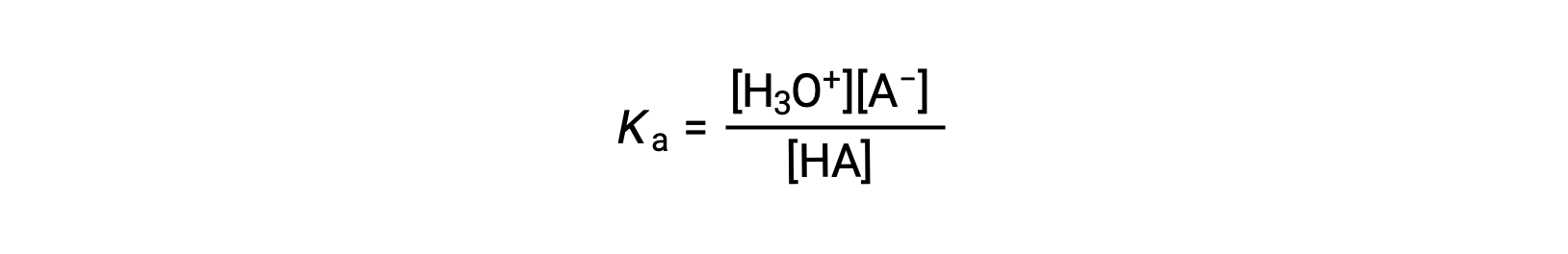
où les concentrations sont celles à l’équilibre. Bien que l’eau soit un réactif dans la réaction, c’est aussi le solvant, nous n’incluons donc pas [H2O] dans l’équation. Plus le Ka d’un acide est élevé, plus la concentration de H3O+ et de A− est importante par rapport à la concentration de l’acide non ionisé HA dans un mélange en équilibre, et plus l’acide est fort. Un acide est classé comme “ fort ” lorsqu’il subit une ionisation totale, auquel cas la concentration de HA est nulle et la constante d’ionisation de l’acide est infiniment grande (Ka ≈ ∞). On dit que les acides partiellement ionisés sont “ faibles ” et leurs constantes d’ionisation de l’acide peuvent être mesurées expérimentalement.
Pour illustrer cette idée, les équations de l’ionisation de trois acides et les valeurs de Ka sont présentées ci-dessous. Les constantes d’ionisation augmentent de la première à la dernière des équations dans la liste, indiquant que la force relative de l’acide augmente dans l’ordre CH3CO2 < HNO2 < HSO4−.
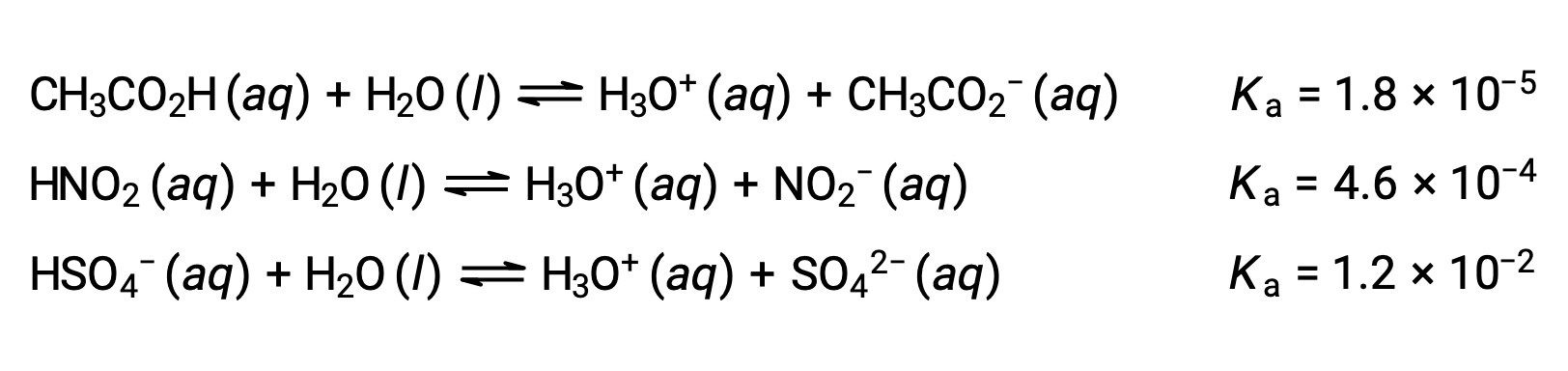
Une autre mesure de la force d’un acide est son ionisation en pourcentage. L’ionisation en pourcentage d’un acide faible est définie du point de vue de la composition d’un mélange en équilibre :
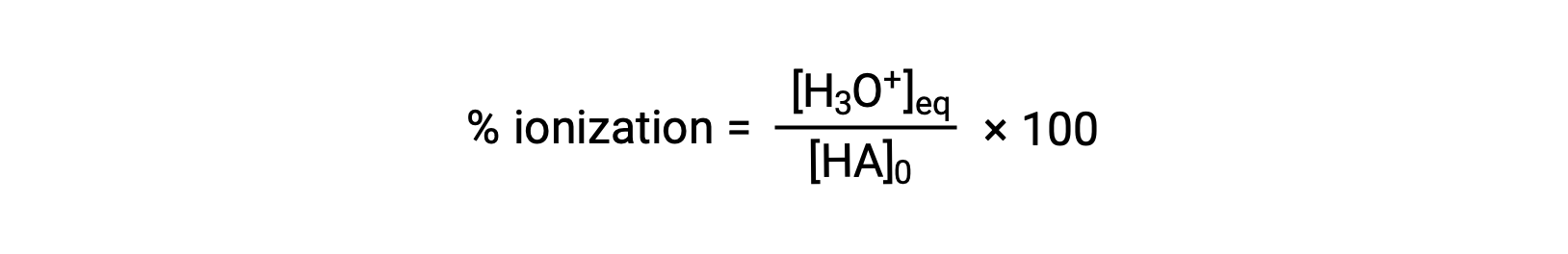
où le numérateur est équivalent à la concentration de la base conjuguée de l’acide (par stœchiométrie, [A−] = [H3O+]). Contrairement à la valeur de Ka, l’ionisation en pourcentage d’un acide faible varie avec la concentration initiale de l’acide, diminuant généralement à mesure que la concentration augmente.
Tout comme pour les acides, la force relative d’une base se reflète dans la taille de sa constante d’ionisation de la base (Kb) dans les solutions aqueuses. Dans des solutions de même concentration, les bases plus fortes s’ionisent de façon plus importante et produisent donc des concentrations d’ions hydroxyde plus élevées que les bases plus faibles. Une base plus forte a une constante d’ionisation plus grande qu’une base plus faible. Pour la réaction d’une base, B :
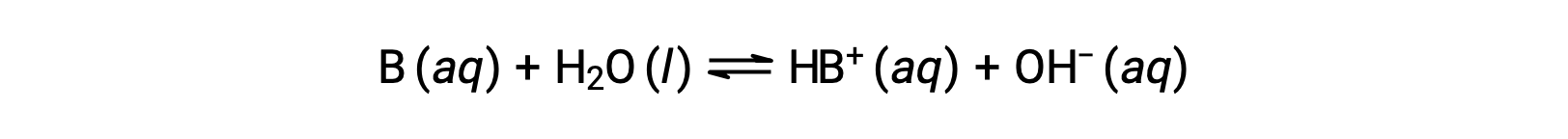
la constante d’ionisation est écrite comme
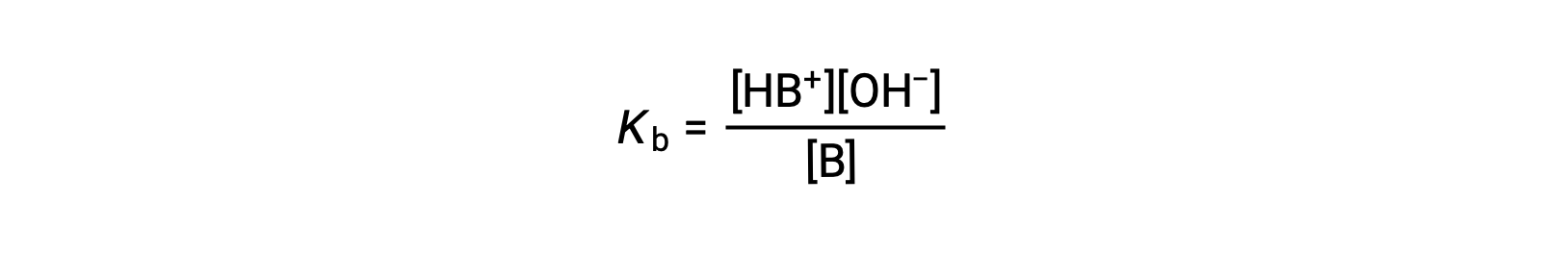
L’inspection des données pour trois bases faibles présentées ci-dessous montre les augmentations de la force des bases dans l’ordre NO2− < CH2CO2− < NH3.
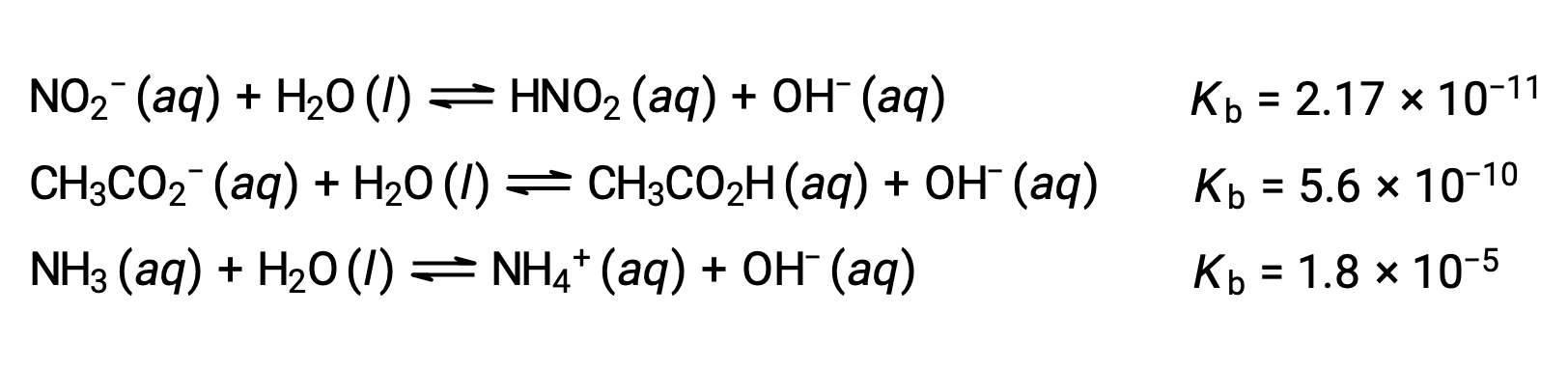
Comme pour les acides, la force relative d’une base se reflète également dans son ionisation en pourcentage, calculée comme
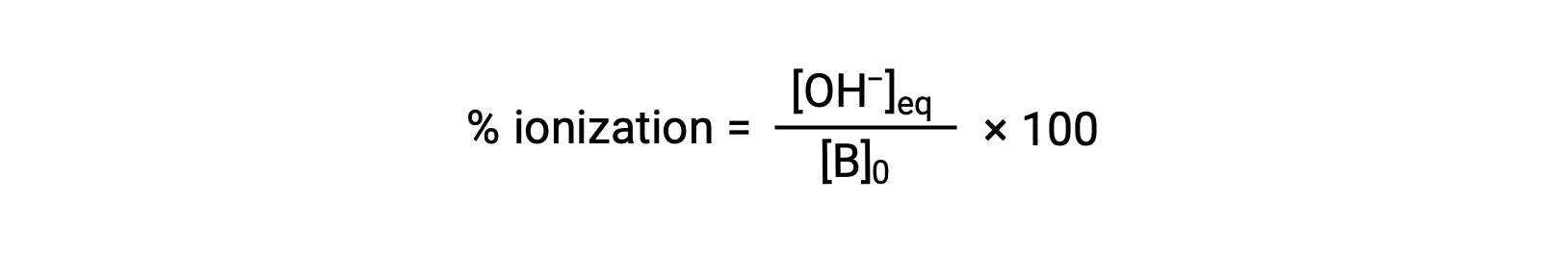
mais varie en fonction de la constante d’ionisation de la base et de la concentration initiale de la solution.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.3 : Forces relatives des acides et des bases.
