15.4:
Échelle de pH
15.4:
Échelle de pH
Les ions hydronium et hydroxyde sont présents à la fois dans l’eau pure et dans toutes les solutions aqueuses, et leurs concentrations sont inversement proportionnelles, comme le détermine le produit ionique de l’eau (KE). Les concentrations de ces ions dans une solution sont souvent des déterminants critiques des propriétés de la solution et des comportements chimiques de ses autres solutés. Deux solutions différentes peuvent différer d’un million, d’un milliard, voire d’un billion de fois leurs concentrations en ions hydronium ou hydroxyde. Un moyen courant d’exprimer des quantités qui peuvent s’étendre sur de nombreux ordres de grandeur est d’utiliser une échelle logarithmique. Le pH d’une solution est donc défini comme indiqué ici, où [H3O+] est la concentration molaire de l’ion hydronium dans la solution :
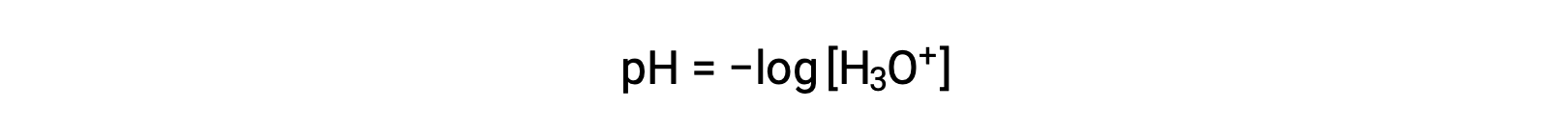
La réorganisation de cette équation pour isoler la molarité de l’ion hydronium donne l’expression équivalente :
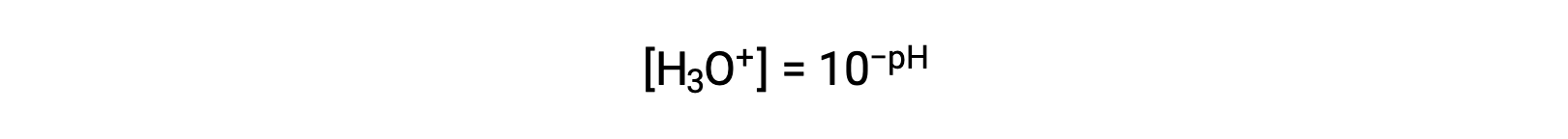
De même, la molarité de l’ion hydroxyde peut être exprimée comme une fonction-p ou pOH :
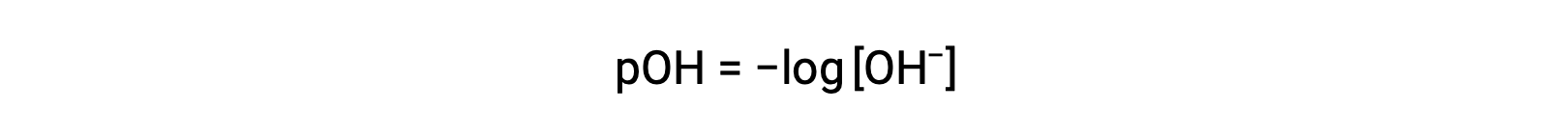
ou
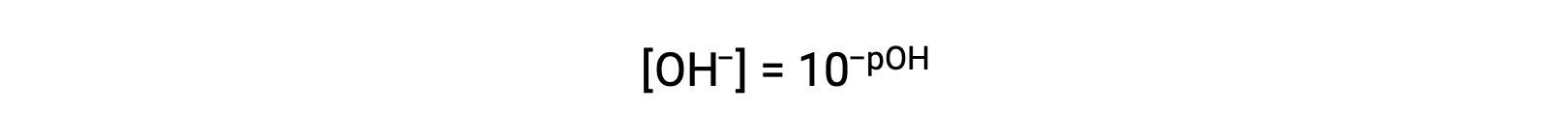
Enfin, la relation entre ces deux concentrations d’ions exprimées sous forme de fonctions-p est facilement dérivée de l’expression de KE :
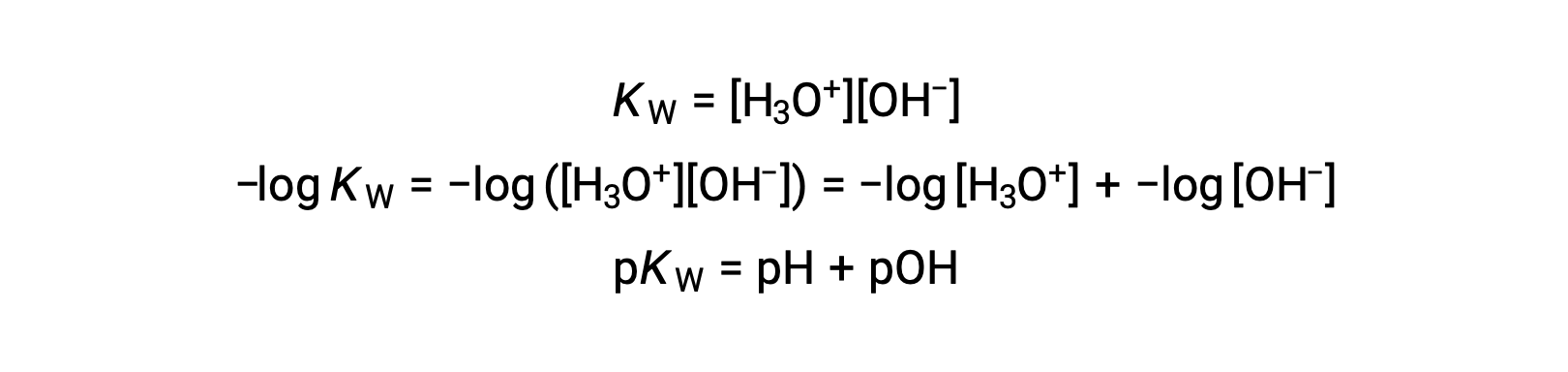
À 25 °C, la valeur de KE est de 1,0 × 10−14, et donc :
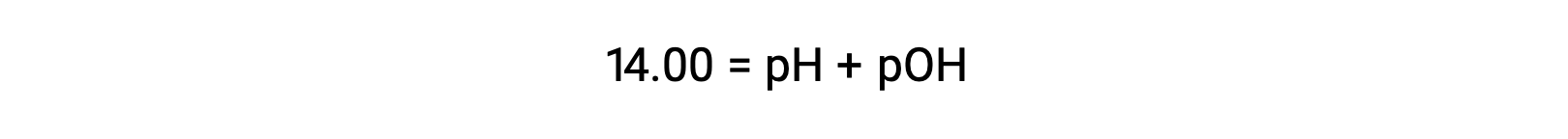
La molarité de l’ion hydronium dans l’eau pure (ou toute solution neutre) est de 1,0 × 10−7 M à 25 °C. Le pH et le pOH d’une solution neutre à cette température sont donc :
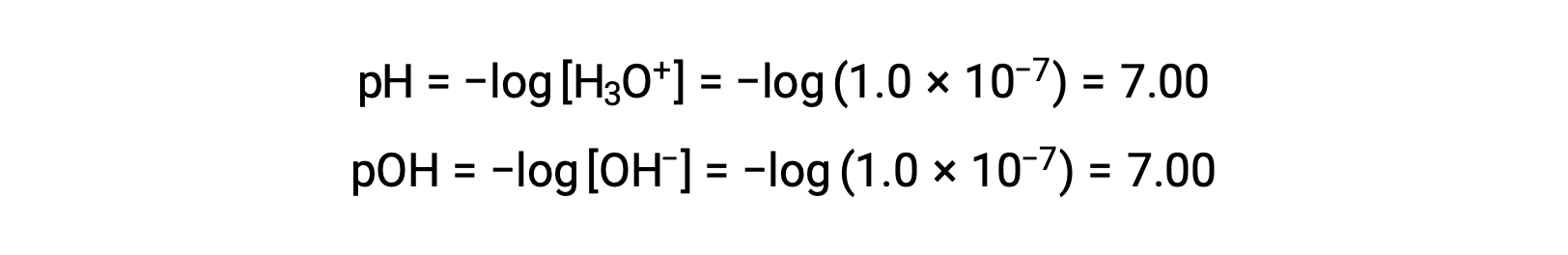
Ainsi, à cette température, les solutions acides sont celles ayant des molarités en ions hydronium supérieures à 1,0 × 10−7 M et des molarités en ions hydroxyde inférieures à 1,0 × 10−7 M (correspondant à des valeurs de pH inférieures à 7,00 et à des valeurs de pOH supérieures à 7,00). Les solutions basiques sont celles dont les molarités en ions hydronium sont inférieures à 1,0 × 10−7 M et les molarités en ions hydroxyde supérieures à 1,0 × 10−7 M (correspondant à des valeurs de pH supérieures à 7,00 et à des valeurs de pOH inférieures à 7,00).
Comme la constante d’auto-ionisation KE dépend de la température, ces corrélations entre les valeurs de pH et les adjectifs acides/neutres/basiques seront différentes à des températures autres que 25 °C. Par exemple, la molarité en hydronium de l’eau pure à 80 °C est de 4,9 × 10−7 M, ce qui correspond aux valeurs de pH et de pOH de :
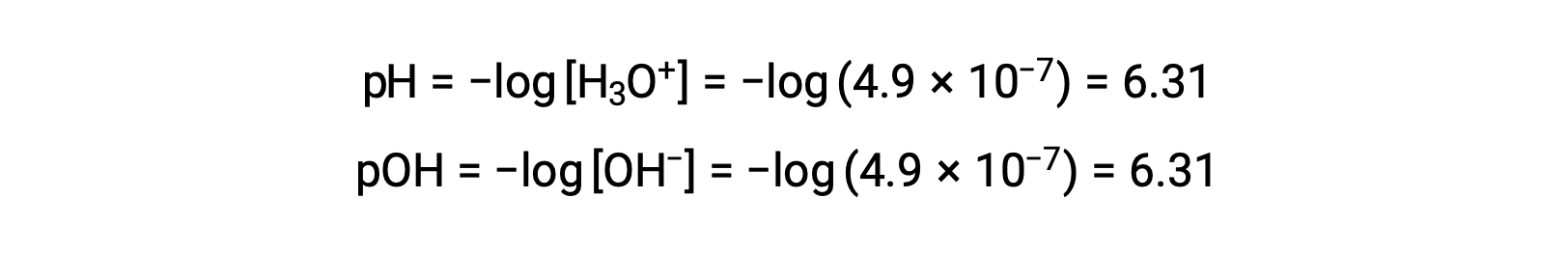
À cette température, les solutions neutres présentent un pH = pOH = 6,31 ; les solutions acides présentent un pH inférieur à 6,31 et un pOH supérieur à 6,31 alors que les solutions basiques présentent un pH supérieur à 6,31 et un pOH inférieur à 6,31. Cette distinction peut être importante lorsqu’on étudie certains processus qui se produisent à d’autres températures, comme les réactions enzymatiques dans les organismes à sang chaud à une température d’environ 36 – 40 °C. Sauf indication contraire, les références aux valeurs de pH sont supposées être celles à 25 °C.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.2 : pH et pOH.
Suggested Reading
- van Lubeck, Henk. "Why not replace pH and pOH by just one real acidity grade, AG?." Journal of Chemical Education 76, no. 7 (1999): 892. https://pubs.acs.org/doi/pdf/10.1021/ed076p892
