15.4: pH值
水合氢离子和氢氧化物离子存在于纯水中和所有水溶液中,其浓度按水的离子生成物 (kW) 的决定呈反比比例。 这些离子在溶液中的浓度通常是该溶液性质及其其他溶质的化学行为的关键决定因素。 两种不同的溶液在其水合氢离子或氢氧化物离子浓度方面可能相差一百万,十亿甚至万亿倍。 表达数量的一个常见方法可能跨越多个数量级,即使用对数刻度。 因此,溶液的 pH 值定义如下所示,其中 [H3O+] 是溶液中水合氢离子的摩尔浓度:
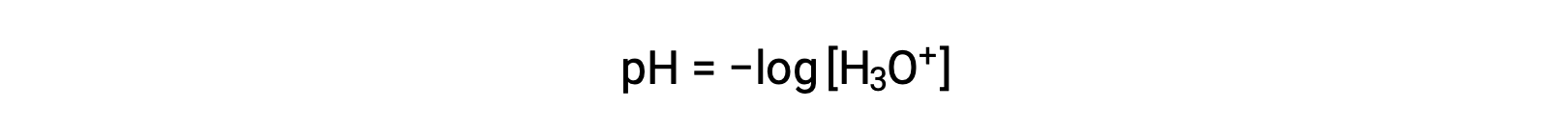
重新排列此方程以将水合氢离子体积摩尔浓度产率隔离为等效表达式:
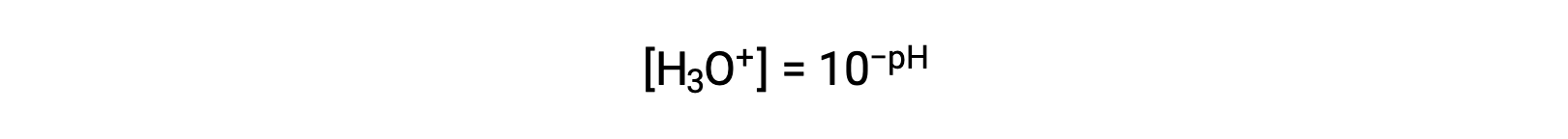
同样,氢氧化物离子体积摩尔浓度可以用 p- 函数或 POH 表示:
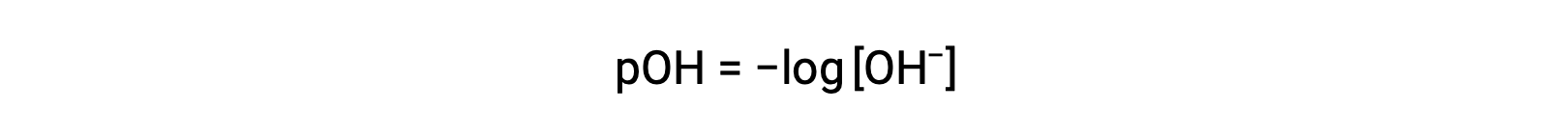
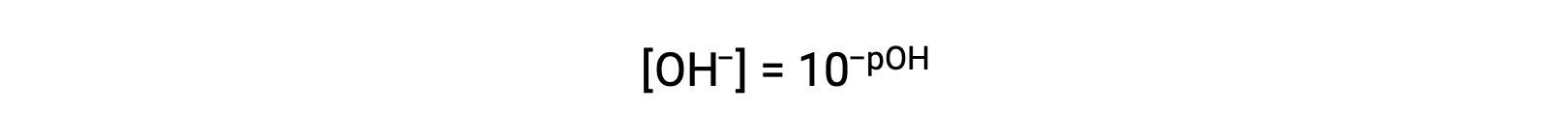
最后,这两个以 p- 函数表示的离子浓度之间的关系很容易从 KW 表达式中导出:
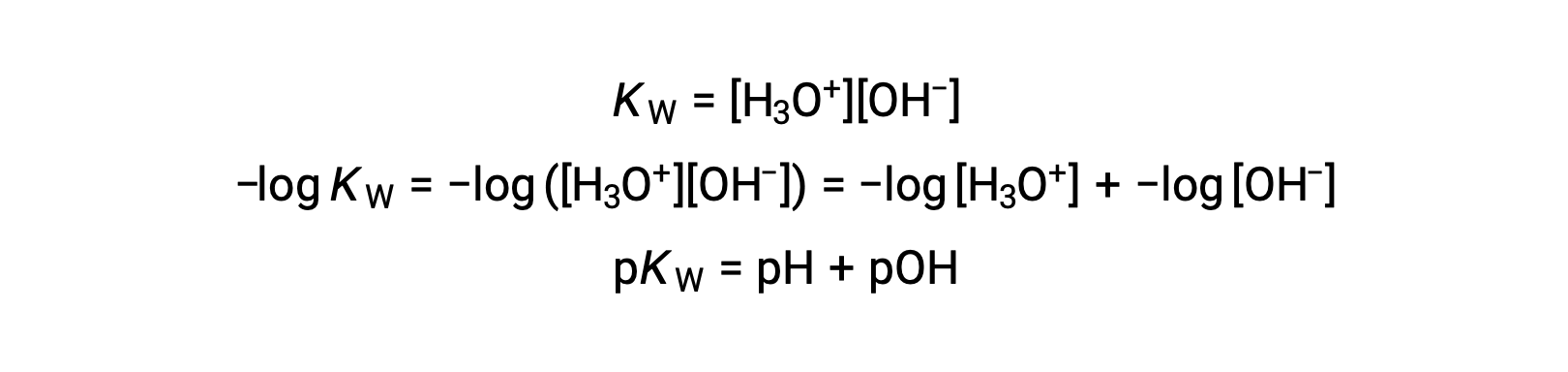
25 °C 时,KW的值为 1.0 × 10−14 ,因此:
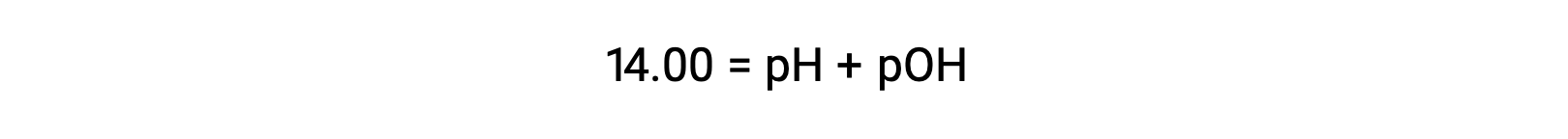
在 25 °C 下,纯水 (或任何中性溶液) 中的水合氢离子体积摩尔浓度为 1.0 × 10−7 M 因此,在此温度下,中性溶液的 pH 值和 pOH 为:
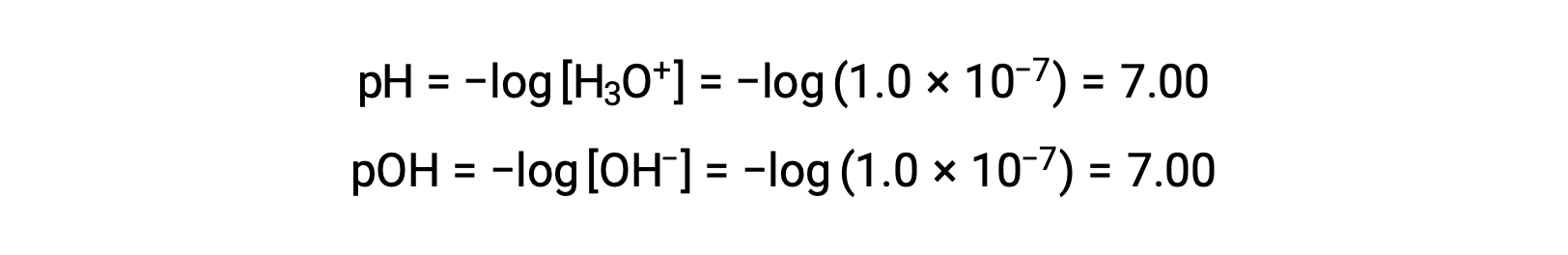
因此,在此温度下,酸性溶液是水合氢离子极性大于 1.0 × 10−7 M 且氢氧化物离子极性小于 1.0 × 10−7 M (对应于 pH 值小于 7.00 且 POH 值大于 7.00) 的。 基础溶液是水合氢离子极性小于 1.0 × 10−7 M 且氢氧化物离子极性大于 1.0 × 10−7 M (对应于 pH 值大于 7.00 且 pOH 值小于 7.00) 的情况。
由于自电离常数 KW 取决于温度,因此在温度不超过 25 °C 的情况下, pH 值与酸性 / 中性 / 基本形容词之间的相关性会有所不同 例如, 80°C 纯水的水合氢离子体积摩尔浓度为 4.9 × 10−7 M ,与 pH 值和 pOH 值对应:
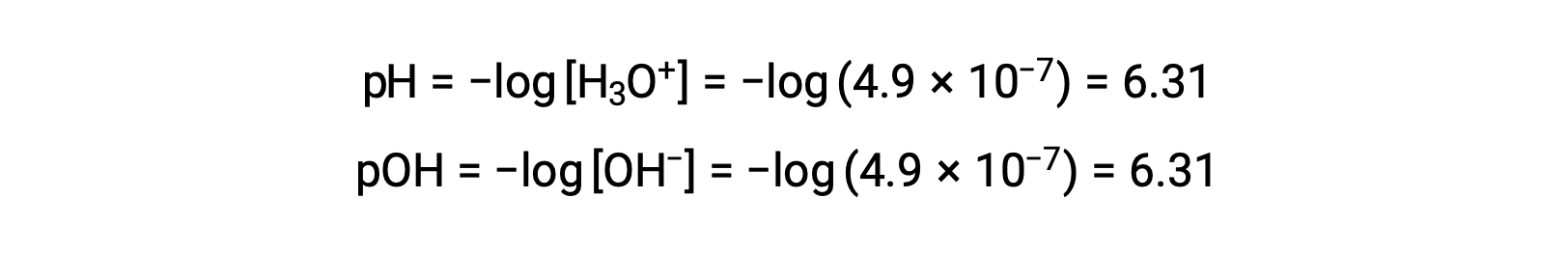
在此温度下,中性溶液的 pH 值 = pOH = 6.31 ,酸性溶液的 pH 值低于 6.31 ,而碱性溶液的 pH 值高于 6.31 ,而酸性 的 pH 值低于 6.31。 这种区分在研究其他温度下发生的某些过程 (例如在 36 – 40 °C 左右的温度下热漂白生物中的酶反应) 时非常重要 除非另有说明,否则 pH 值的参考被推定为 25 °C
本文改编自 Openstax, 化学 2e, 第 14.2节: pH 值和pOH。


