15.4:
Escala del pH
15.4:
Escala del pH
Los iones hidronio e hidróxido están presentes tanto en agua pura como en todas las soluciones acuosas, y sus concentraciones son inversamente proporcionales según lo determinado por el producto iónico del agua (Kw). Las concentraciones de estos iones en una solución son a menudo determinantes críticos de las propiedades de la solución y de los comportamientos químicos de sus otros solutos. Dos soluciones diferentes pueden diferir en sus concentraciones de iones hidronio o hidróxido en un millón, mil millones o incluso billones de veces. Un medio común de expresar cantidades que pueden abarcar muchos órdenes de magnitud es utilizar una escala logarítmica. Por lo tanto, el pH de una solución se define como se muestra aquí, donde [H3O+] es la concentración molar de iones hidronio en la solución:
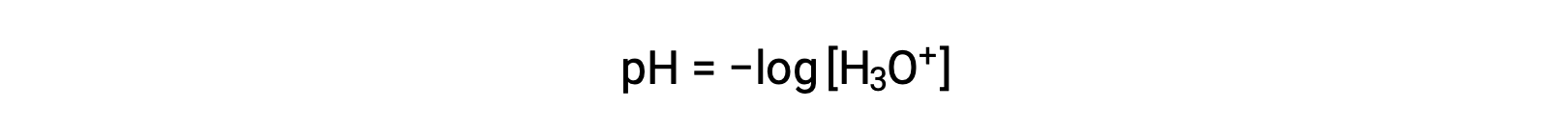
La reorganización de esta ecuación para aislar la molaridad del ion hidronio produce la expresión equivalente:
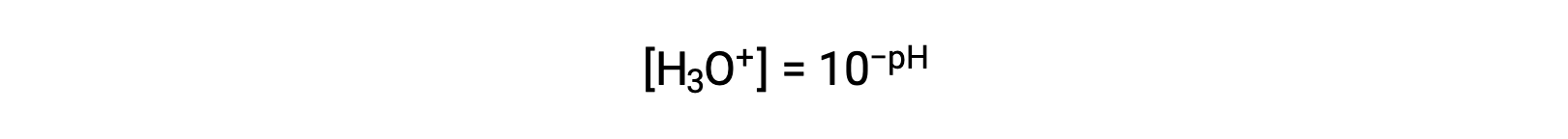
Asimismo, la molaridad de los iones hidróxido puede expresarse como una función p o pOH:
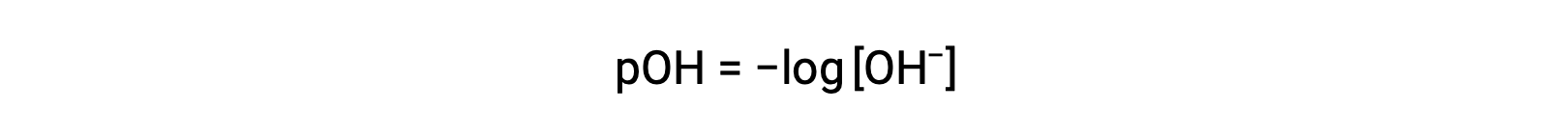
o bien
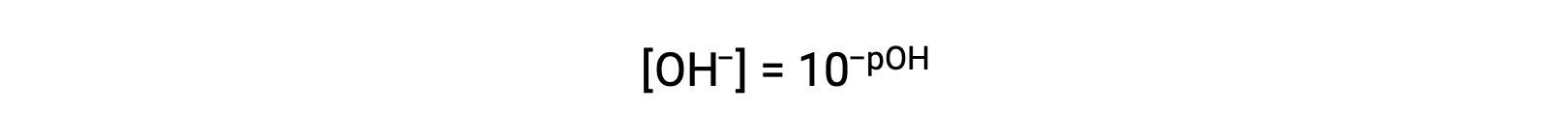
Por último, la relación entre estas dos concentraciones de iones expresadas como funciones p se obtiene fácilmente de la expresión Kw:
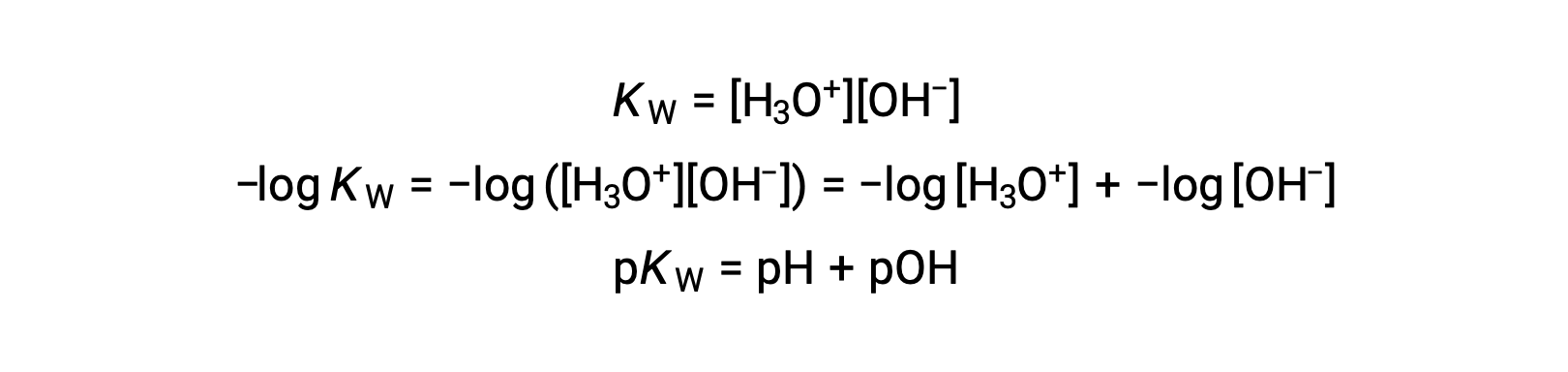
A 25 °C, el valor de Kw es de 1,0 × 10−14, por lo que:
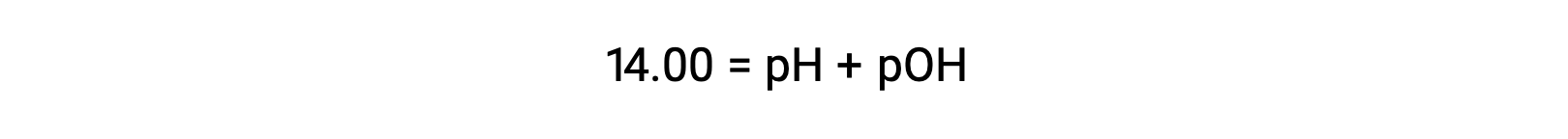
La molaridad de iones hidronio en agua pura (o cualquier solución neutra) es de 1,0 × 10−7 M a 25 °C. Por lo tanto, el pH y el pOH de una solución neutra a esta temperatura son:
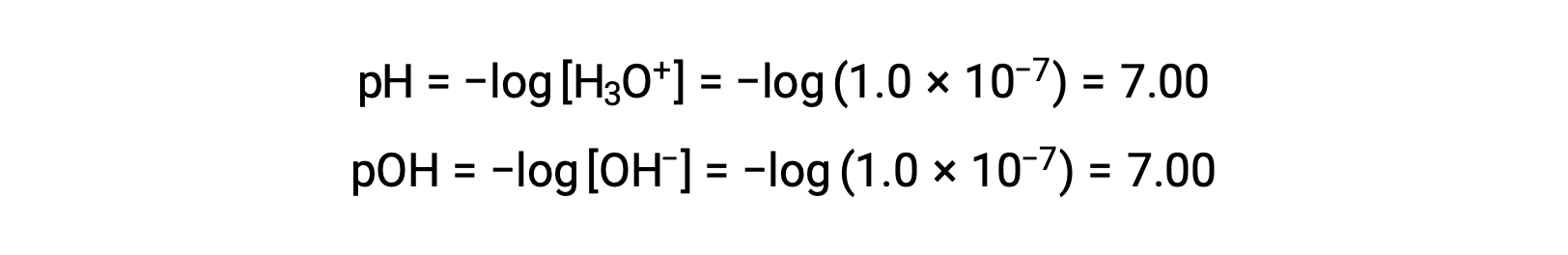
Y así, a esta temperatura, las soluciones ácidas son aquellas con molaridades de iones hidronio superiores a 1,0 × 10−7 M y molaridades de iones hidróxido inferiores a 1,0 × 10−7 M (correspondientes a valores de pH inferiores a 7,00 y valores de pOH superiores a 7,00). Las soluciones básicas son aquellas con molaridades de iones hidronio inferiores a 1,0 × 10−7 M y molaridades de iones hidróxido superiores a 1,0 × 10−7 M (correspondientes a valores de pH superiores a 7,00 y valores de pOH inferiores a 7,00).
Dado que la constante de autoionización Kw depende de la temperatura, estas correlaciones entre los valores de pH y los adjetivos ácido/neutro/básico serán diferentes a temperaturas distintas de 25 °C. Por ejemplo, la molaridad del hidronio del agua pura a 80°C es de 4,9 × 10−7 M, que corresponde a los valores de pH y pOH de:
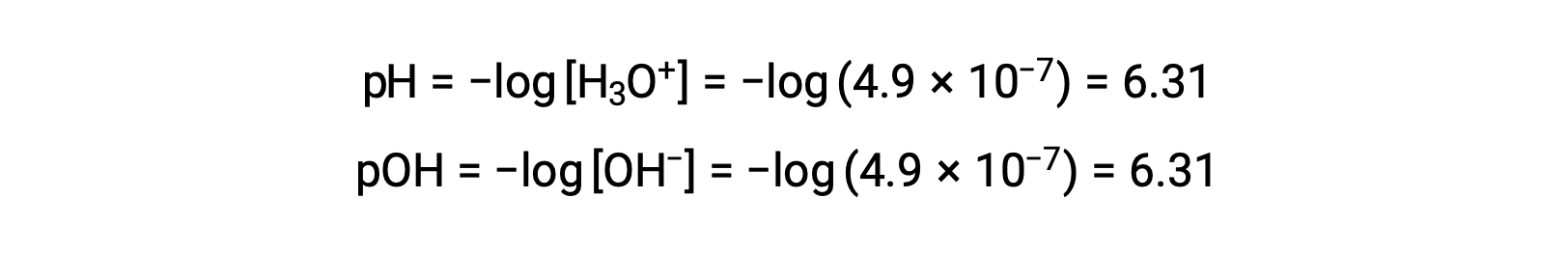
A esta temperatura, las soluciones neutras muestran pH = pOH = 6,31, las soluciones ácidas muestran un pH inferior a 6,31 y un pOH superior a 6,31, mientras que las soluciones básicas muestran un pH superior a 6,31 y un POH inferior a 6,31. Esta distinción puede ser importante cuando se estudian ciertos procesos que ocurren a otras temperaturas, como reacciones enzimáticas en organismos de sangre caliente a una temperatura alrededor de 36 – 40 °C. A menos que se indique lo contrario, se presumirá que las referencias a los valores de pH son aquellas a 25 °C.
Este texto es adaptado de Openstax, Química 2e, Sección 14.2: pH y pOH.
Suggested Reading
- van Lubeck, Henk. "Why not replace pH and pOH by just one real acidity grade, AG?." Journal of Chemical Education 76, no. 7 (1999): 892. https://pubs.acs.org/doi/pdf/10.1021/ed076p892
