15.4:
шкала pH
15.4:
шкала pH
Ионы гидрония и гидроксида присутствуют как в чистой воде, так и во всех водных растворах, и их концентрации обратно пропорциональны, как определено ионным продуктом воды (кВт). Концентрации этих ионов в раствор часто являются критическими детерминантами свойств решения и химического поведения других его солей. Два различных решения могут отличаться в концентрациях гидрония или гидроксида ионов в миллионах, миллиардах или даже триллионах раз. Общераспространенным средством выражения величин, которые могут охватывать многие порядки величины, является использование логарифмической шкалы. Таким образом, pH раствор определяется, как показано на рисунке, где [H3O+] — молярная концентрация гидрония в ионе раствор:
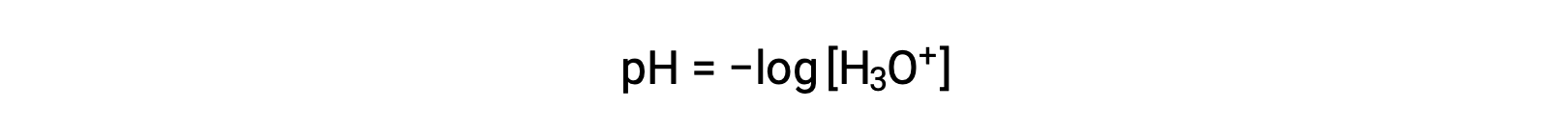
Переупорядочивание этого уравнения для изоляции молярности ионов гидрония дает эквивалентное выражение:
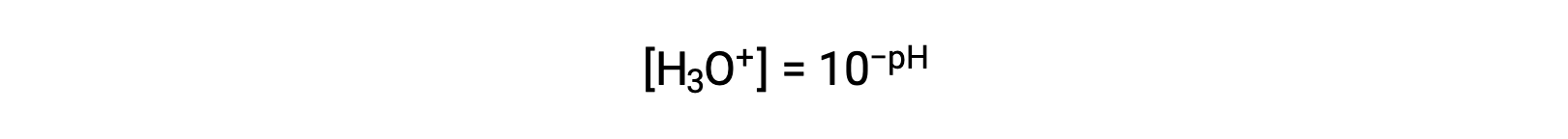
Также молярность ионов гидроксида может быть выражена как p-функция или Poh:
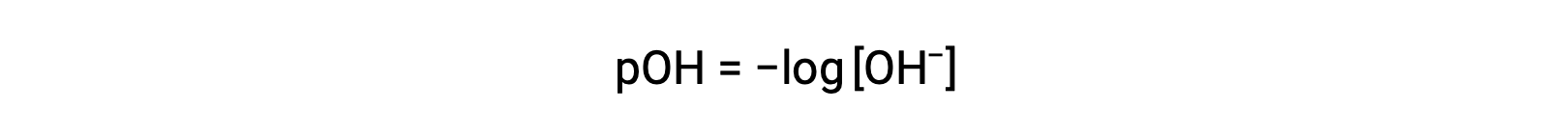
или
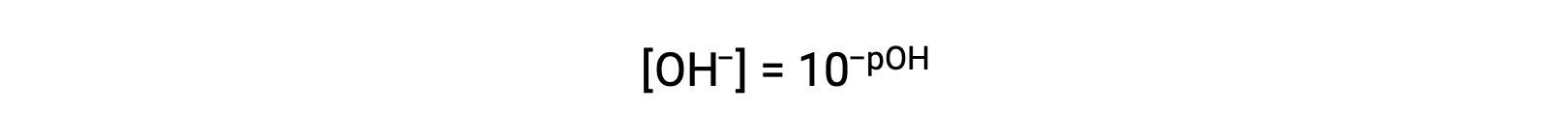
Наконец, соотношение между этими двумя ионными концентрациями, выраженными как p-функции, легко вытекает из выражения KW:
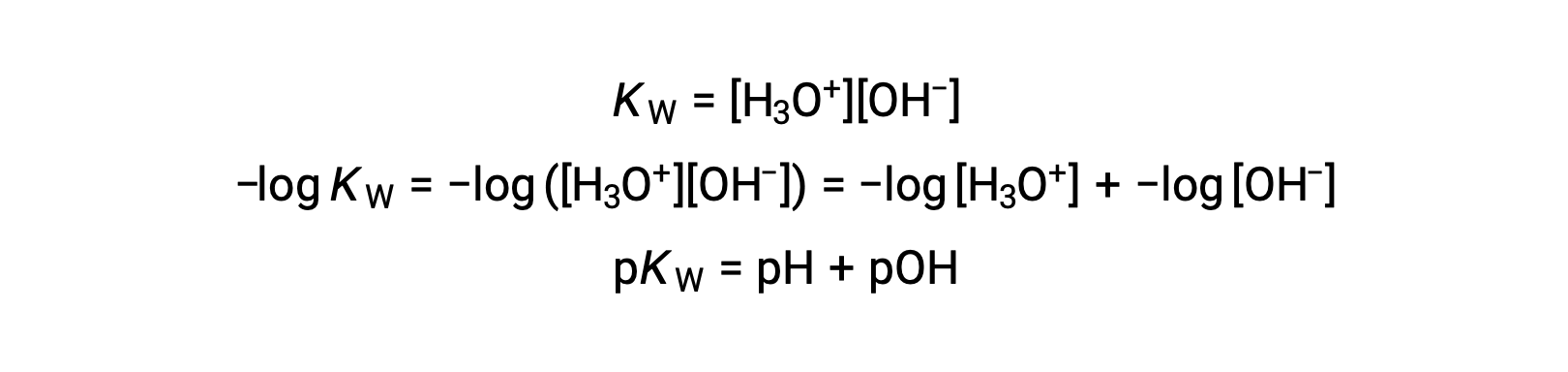
При 25 °C значение КВТ составляет 1.0 × 10-14, и поэтому:
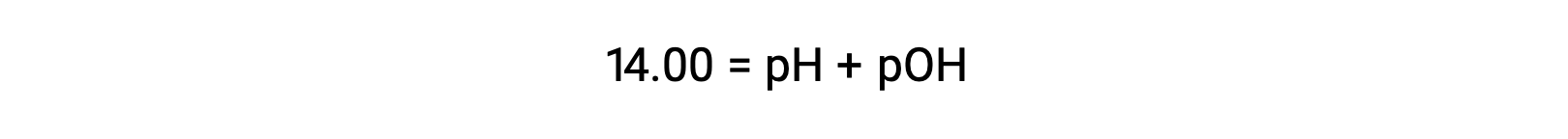
Молярность ионов гидрония в чистой воде (или любом нейтральном раствор) составляет 1.0 × 10-7 M при 25 °C. Поэтому pH и Poh нейтрального раствор при этой температуре:
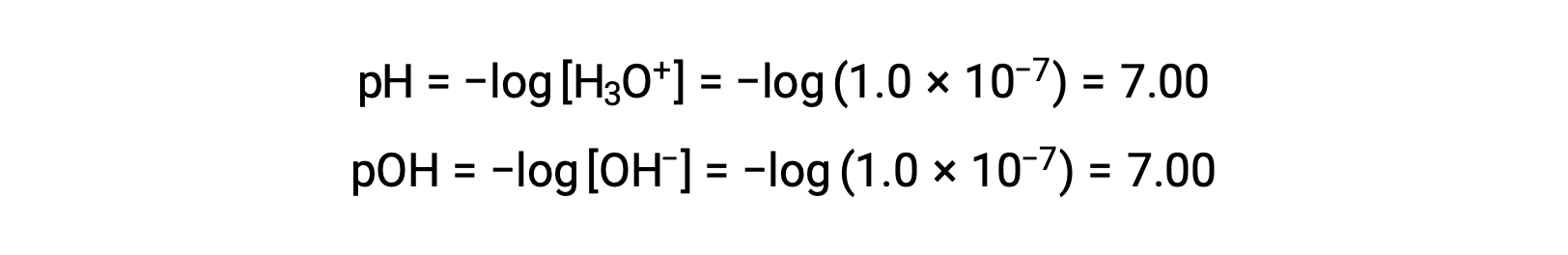
И поэтому при этой температуре кислотные растворы являются растворами с гидронионными ионными молярностями, превышающими 1.0 × 10-7 M, и молярностью гидроксидных ионных ионов менее 1.0 × 10-7 M (соответствующими значениям pH менее 7.00 и значениям Poh больше 7.00). Основными растворами являются растворы с молярностью гидрония иона менее 1.0 × 10-7 M и молярностью гидроксида иона более 1.0 × 10-7 M (соответствующие значениям pH больше 7.00, а значения Poh меньше 7.00).
Поскольку константа автоматической ионизации КВТ зависит от температуры, эти корреляции между значениями pH и кислотными/нейтральными/основными прилагательными будут отличаться при температурах, отличных от 25 °C. Например, молярность гидрония чистой воды при 80°C составляет 4.9 × 10-7 м, что соответствует значениям pH и Poh:
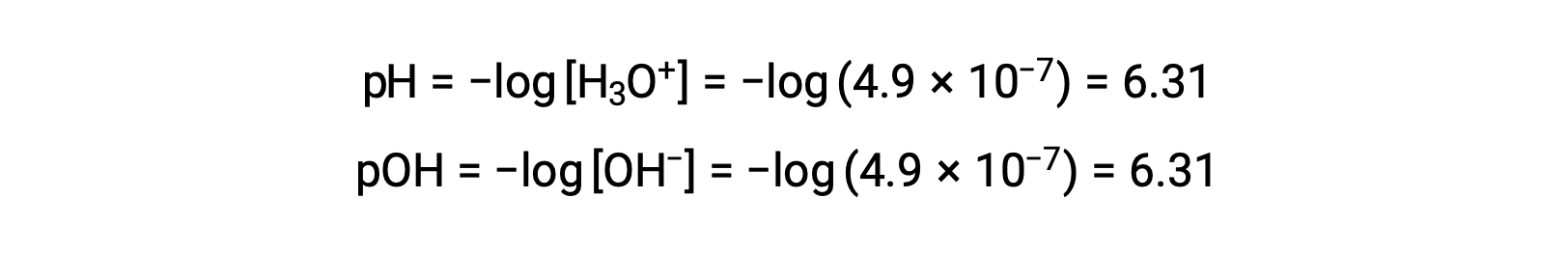
При этой температуре нейтральные растворы демонстрируют pH = Poh = 6.31, кислотные растворы имеют pH менее 6.31 и Poh больше 6.31, тогда как базовые растворы имеют pH больше 6.31 и Poh меньше 6.31. Это различие может быть важно при изучении некоторых процессов, которые происходят при других температурах, таких как реакции фермента в теплокровных организмах при температуре около 36 – 40 °C. Если не указано иное, ссылки на значения pH считаются значениями при 25 °C.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.2: PH и Poh.
Suggested Reading
- van Lubeck, Henk. "Why not replace pH and pOH by just one real acidity grade, AG?." Journal of Chemical Education 76, no. 7 (1999): 892. https://pubs.acs.org/doi/pdf/10.1021/ed076p892
