15.6:
强酸和碱溶液
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Strong Acid and Base Solutions
强酸在溶液中完全分解。例如,硝酸完全分解 成水合氢离子和硝酸根离子。由于水自电离产生的水合氢离子 可以忽略不计,因此 水中水合氢离子的浓度 等于强酸的浓度。这些溶液的 pH 值可以 用强酸的初始浓度来确定。例如,在 0.10 M 的 HCl 溶液中,HCl 将完全分解成水合氢离子 和氯离子,因此溶液中的水合氢离子 浓度也将为 0.10 M。取这个浓度的负对数,溶液的 pH 值等于 1。反过来,溶液的 pH 值可 用于测定溶液中的 水合氢离子浓度。例如,对于 pH 值为 3.60 的溶液,其水合氢离子浓度可通过求解 该方程式来确定,3.60=水合氢离子 浓度的负对数。为了求解该浓度,两边同时乘以 负一,然后取两边的反对数。水合氢离子浓度等于 2.5 10⁻⁴ M.属于第一组金属氢氧化物的强碱,如 氢氧化钠和氢氧化钾,完全分解成溶液。例如,0.20 M 氢氧化钠在水中 会完全解离,将会产生 0.20M 钠离子 和 0.20M 氢氧化物离子。然而,第二组金属氢氧化物,如氢氧化钡和氢氧化钙,每摩尔碱产生两摩尔氢氧化物离子。例如,0.020M 氢氧化钙将在水中 完全离解,并将产生 0.020M 钙离子 和 0.040M 氢氧化物离子。离子型金属氧化物,如氧化钠和氧化钙,也是强碱。它们的氧化物离子与水反应,产生氢氧化物离子。氢氧化物离子的浓度 可用于计算溶液的 pOH 和 pH 值。例如,5×10⁻⁵M 氢氧化钾溶液具有等量的 氢氧化物离子作为强碱,因此 pOH 为 4.30。与 pH 一样,溶液的 pOH 也可 用于通过求解以下方程来确定氢氧化物 离子浓度:pOH 等于氢氧化物 离子浓度的负对数。由于 pH 加 pOH 等于 14,而 pOH 为 4.3,因此溶液的 pH 值为 9.7。
15.6:
强酸和碱溶液
强酸是一种在水溶液中完全分离的化合物,产生的浓度为水合氢离子,等于酸的初始浓度。 例如, 0.20 M 氢溴酸将在水中完全分离,产生 0.20 M 水合氢离子和 0.20 M 溴离子。

另一方面,强碱是一种在水溶液中完全分离并产生氢氧化物离子的化合物。 例如, 0.015 M KOH (1 类金属氢氧化物) 将完全分离,产生 0.015 M OH– 和 0.015 M K+。
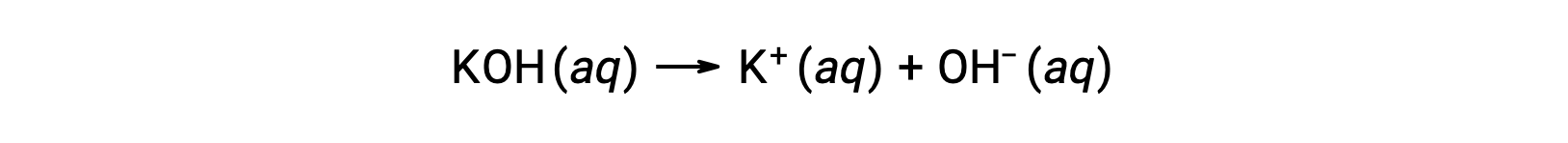
第 2 类金属氢氧化物,如钡氢氧化物 [Ba(OH)2] 和锶氢氧化物 [Sr(OH)2],也是强碱,并拥有两个氢氧化物离子。 这就导致他们在同一个浓度生产比 NaOH 或 KOH 更基本的溶液。 例如, 0.015 M Ba(OH)2 产生 0.015 M Ba+ 和 0.030 M 氢氧化物。
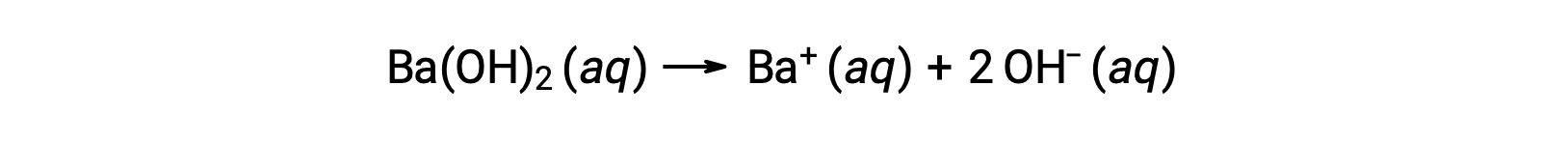
由于强酸和碱完全分离,摩尔比可用于确定其水合氢离子和氢氧化物浓度,而后者可用于计算溶液的 pH 或 pOH。 例如, 0.030 M HCl 溶液将产生 0.03 M 水合氢离子。 因此,该溶液的 pH 值将为

可以使用确定同一溶液的 pOH 公式
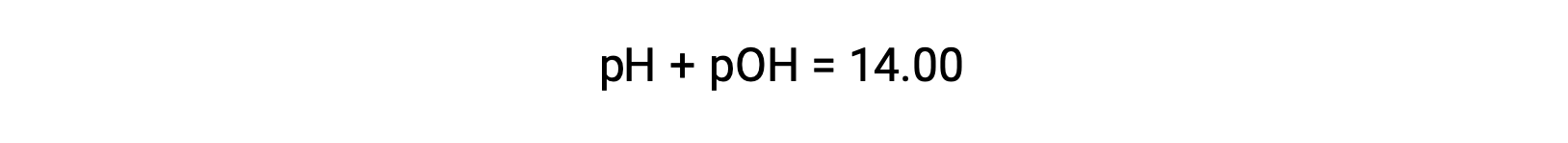
由于溶液的 pH 值为 1.52 ,其 pOH 可以计算为

同样,强碱产生的氢氧化物离子的浓度可用于使用方程测定溶液的 pOH
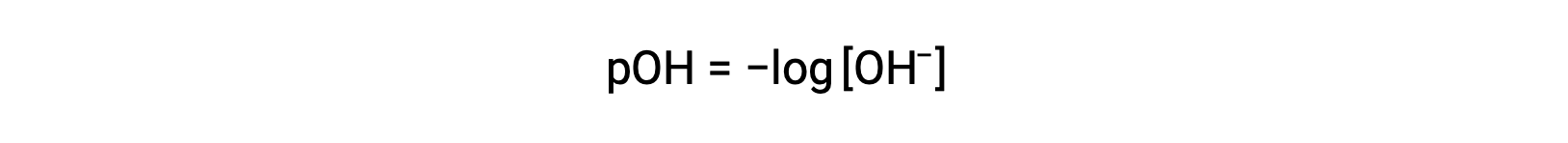
当已知 pOH 时,上述方程也可用于确定氢氧化物离子浓度。 例如,如果溶液的 pOH 为 3.00 ,
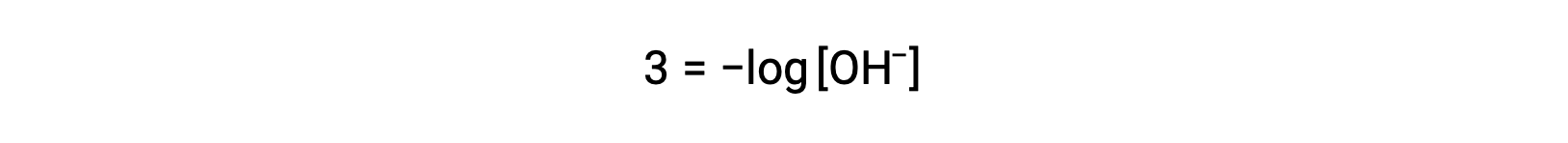
两侧乘以 −1 给出
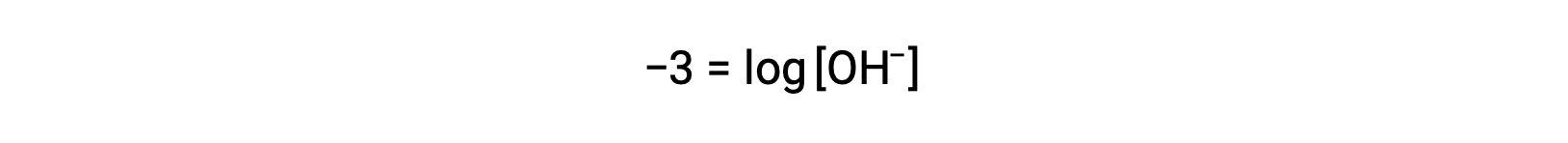
现在,两侧都提反对数
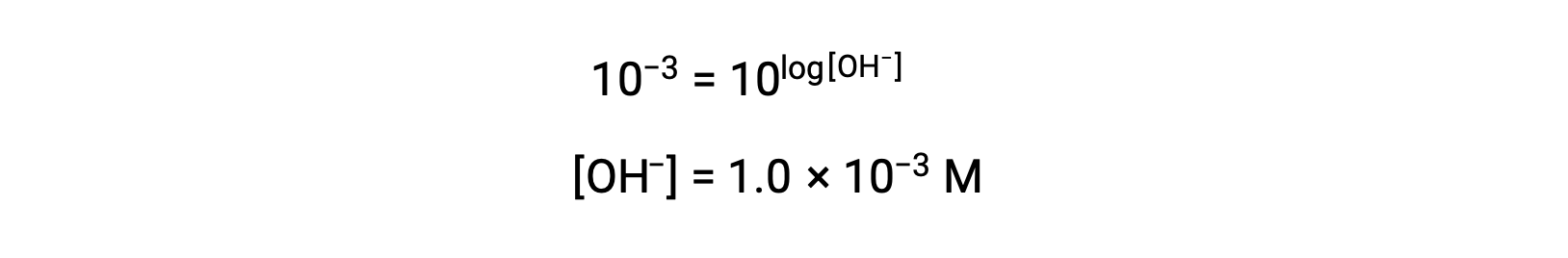
因此,带有 pOH 3 的溶液的水合氢离子浓度为 1.0 × 10−3 M。 如果已知溶液的 pH 值,可以使用类似方法来确定其水合氢离子浓度。
