15.6: 強酸、強塩基性溶液
強酸とは、水溶液中で完全に解離し、酸の初期濃度と同じ濃度のヒドロニウムイオンを生成する化合物のことです。例えば、0.20 Mの臭化水素酸は水中で完全に解離し、0.20 Mのヒドロニウムイオンと0.20 Mの臭化物イオンを生成します。

一方、強塩基とは、水溶液中で完全に解離して水酸化物イオンを生成する化合物のことです。例えば、1族金属の水酸化物である0.015 MのKOHは、完全に解離して0.015 MのOH-と0.015 MのK+を生成します。
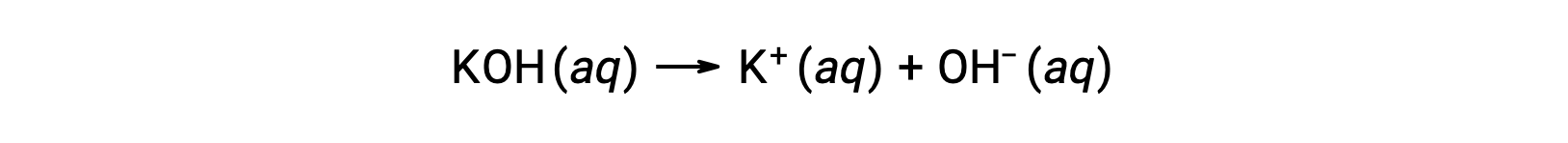
水酸化バリウム[Ba(OH)2]や水酸化ストロンチウム[Sr(OH)2]などの2族金属水酸化物も強塩基であり、2つの水酸化物イオンを持っています。そのため、同じ濃度のNaOHやKOHに比べて、より塩基性の強い溶液を生成します。例えば、0.015 MのBa(OH)2 は0.015 MのBa+ と0.030 Mの水酸化物イオンを生成します。
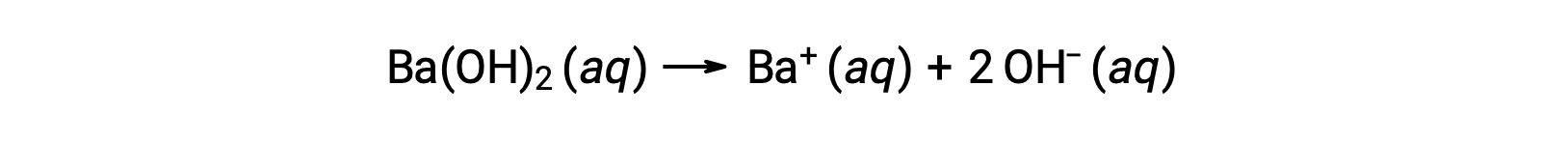
強酸と強塩基は完全に解離するので、モル比からヒドロニウムイオンと水酸化物イオンの濃度を求め、それをもとに溶液のpHやpOHを算出することができます。例えば、0.030 Mの塩酸溶液は、0.030 Mのヒドロニウムイオンを生成します。したがって、この溶液のpHは次の通りです。

同じ溶液のpOHは、次の式で求めることができます。
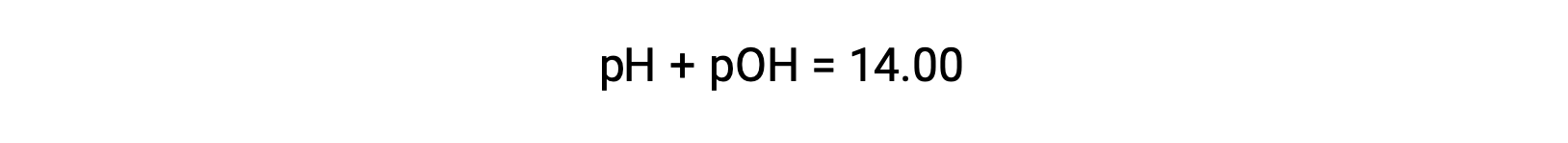
溶液のpHは1.52なので、そのpOHは次のように計算できます。

同様に、強塩基によって生成される水酸化物イオンの濃度は、次式を用いて溶液のpOHに変換することが出来ます。
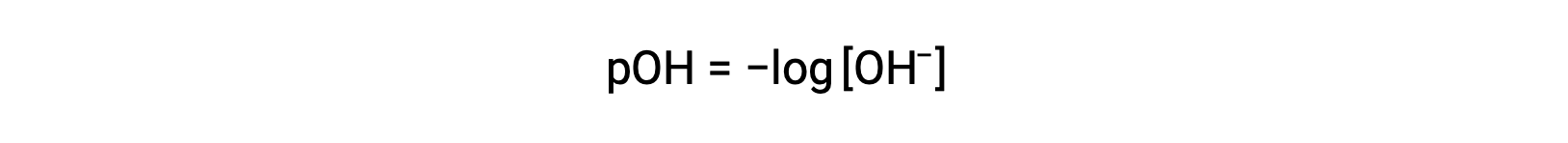
上の式は、pOHが既知の場合、水酸化物イオン濃度を求めるのにも使用できます。例えば、溶液のpOHが3.00の場合は次の通りです。
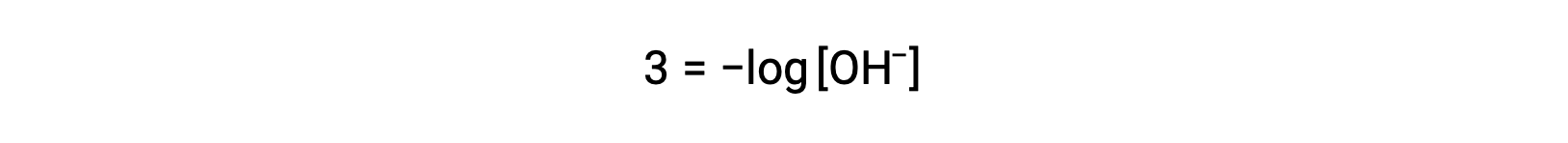
両辺に −1 を乗じると、
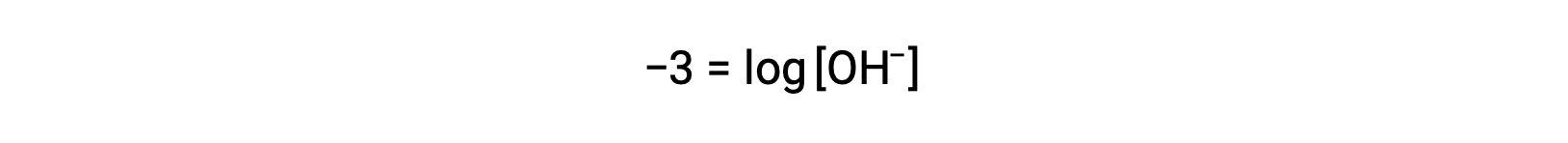
Now, take the antilog of both sides
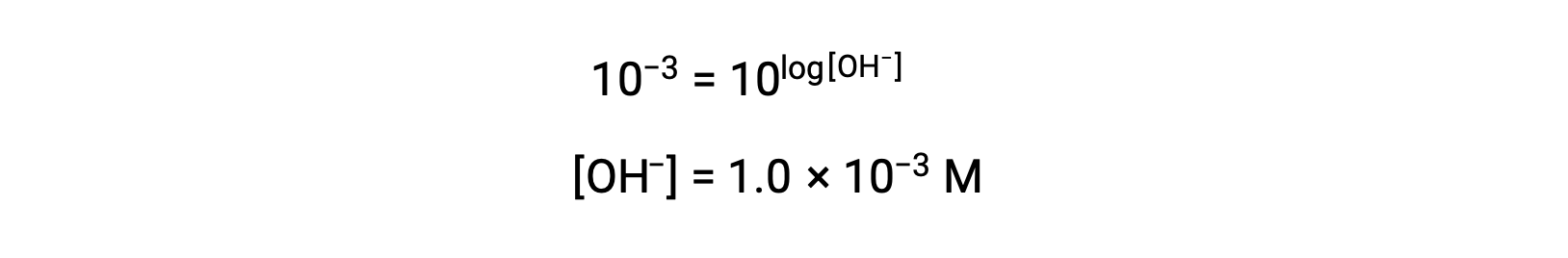
したがって、pOH 3の溶液のヒドロニウムイオン濃度は1.0 × 10−3 Mとなります。同様の方法で、溶液のpHがわかっている場合には、ヒドロニウムイオン濃度を求めることができます。


