15.6:
Soluciones de Ácidos y Bases Fuertes
15.6:
Soluciones de Ácidos y Bases Fuertes
Un ácido fuerte es un compuesto que se disocia completamente en una solución acuosa y produce una concentración de iones hidronio igual a la concentración inicial del ácido. Por ejemplo, el ácido hidrobrómico 0,20 M se disociará completamente en el agua y produce 0,20 M de iones hidronio y 0,20 M de iones bromuro.

Por otro lado, una base fuerte es un compuesto que se disocia completamente en una solución acuosa y produce iones hidróxido. Por ejemplo, 0,015 M KOH, un hidróxido metálico del grupo 1, se disociará completamente y producirá 0,015 M de OH− y 0,015 M de K+.
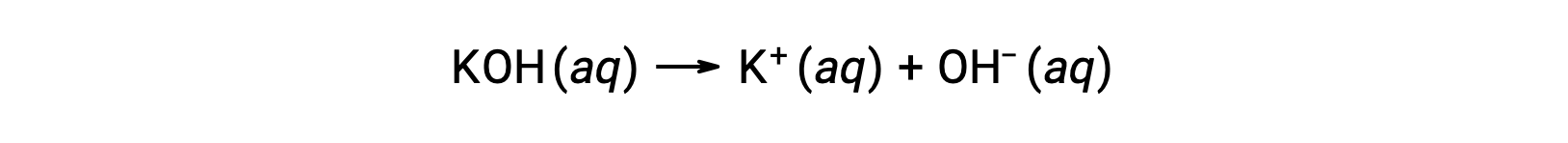
Los hidróxidos metálicos del grupo 2, como el hidróxido de bario [Ba(OH)2] y el hidróxido de estroncio [Sr(OH)2], también son bases fuertes y poseen dos iones hidróxido. Esto hace que produzcan una solución más básica en comparación con el NaOH o el KOH en la misma concentración. Por ejemplo, 0,015 M Ba(OH)<sub2 produce 0,015 M de Ba + y 0,030 M de hidróxido.
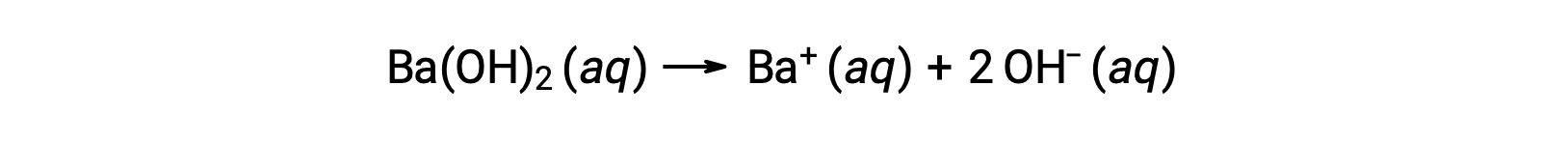
A medida que los ácidos y bases fuertes se disocian completamente, se pueden utilizar relaciones molares para determinar sus concentraciones de hidronio e hidróxido, que a su vez pueden utilizarse para calcular el pH o el pOH de una solución. Por ejemplo, una solución de HCl 0,030 M producirá iones hidronio 0,03 M. Por lo tanto, el pH de esta solución será

El pOH de la misma solución puede determinarse utilizando la fórmula
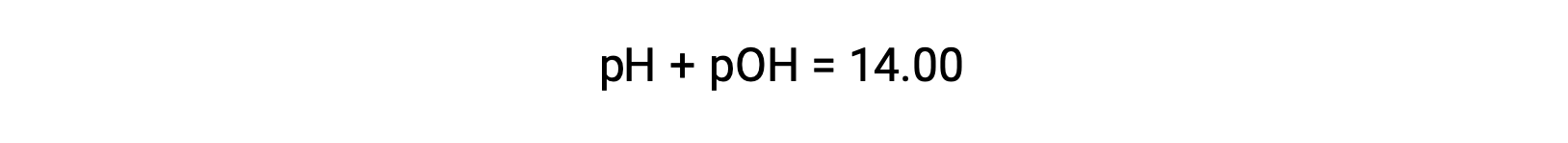
Como el pH de la solución es 1,52, su pOH se puede calcular como

De igual manera, la concentración de iones hidróxido producidos por bases fuertes puede utilizarse para determinar el pOH de una solución utilizando la ecuación
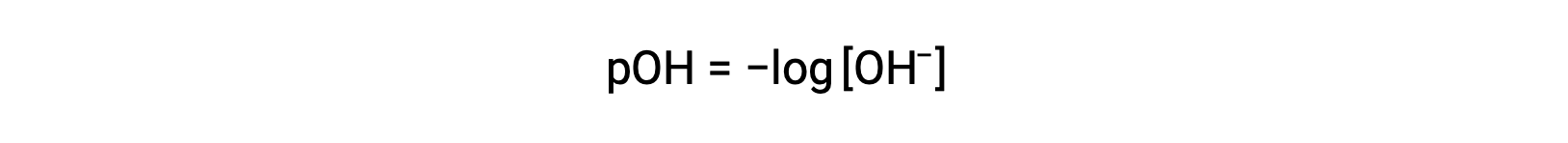
La ecuación anterior también puede utilizarse para determinar la concentración de iones hidróxido cuando se conoce el pOH. Por ejemplo, si el pOH de una solución es 3,00,
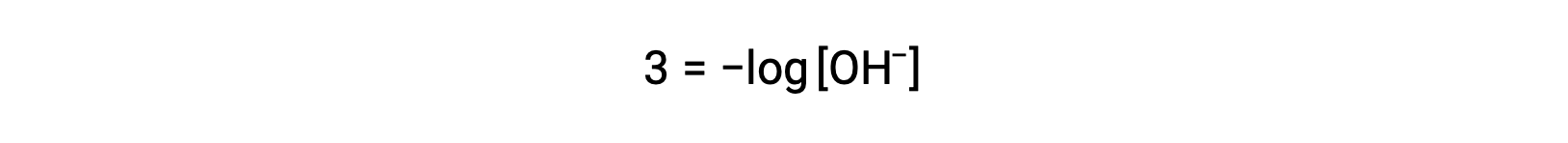
La multiplicación de ambos lados por −1 da
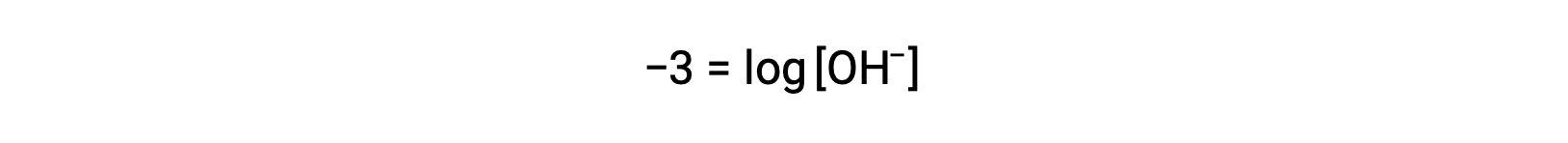
Ahora, tome el antilogaritmo de ambos lados
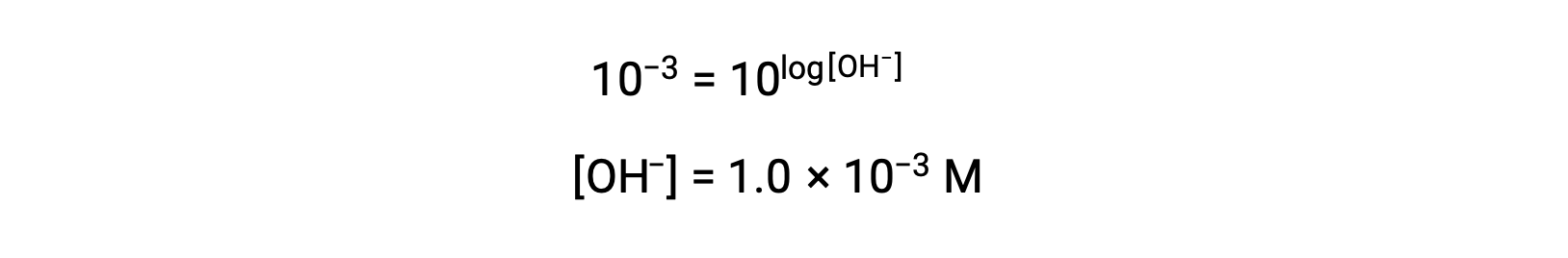
Por lo tanto, la concentración de iones hidronio de la solución con pOH 3 es de 1,0 × 10−3 M. Se puede utilizar un método similar para determinar la concentración de iones de hidronio de una solución si se conoce su pH.
