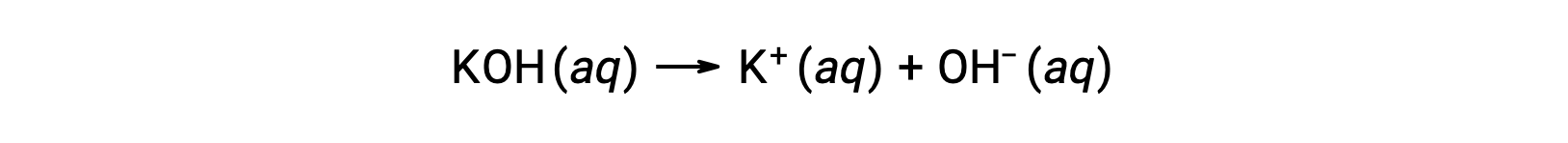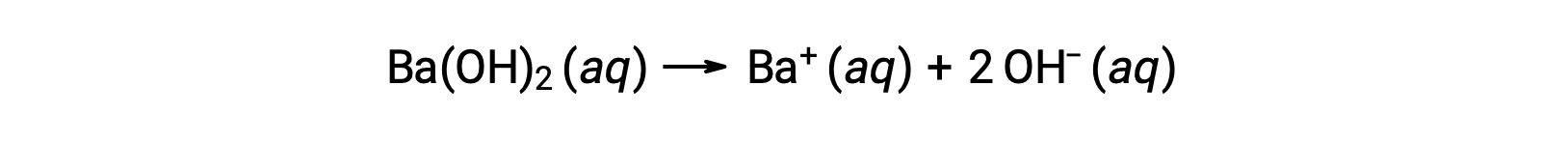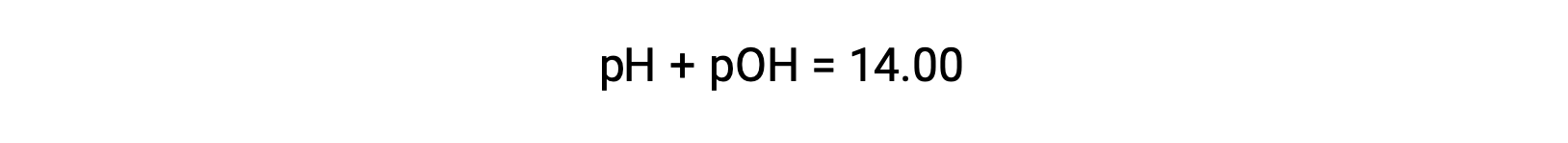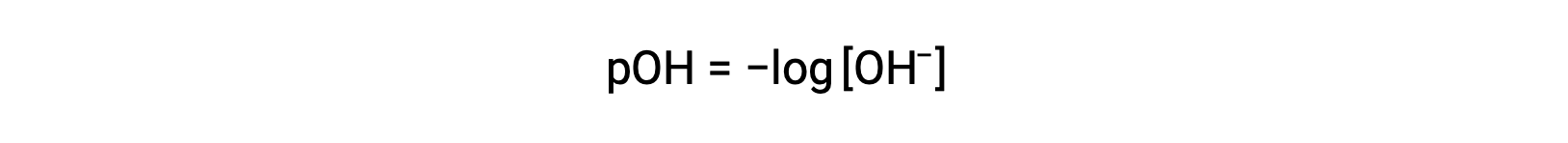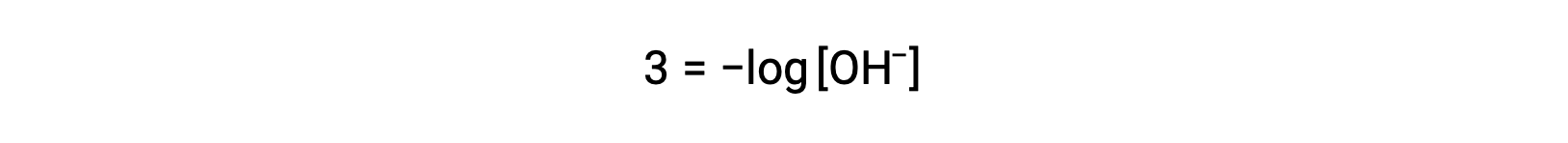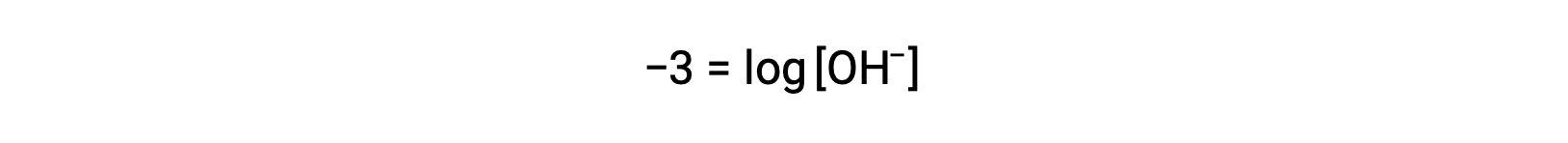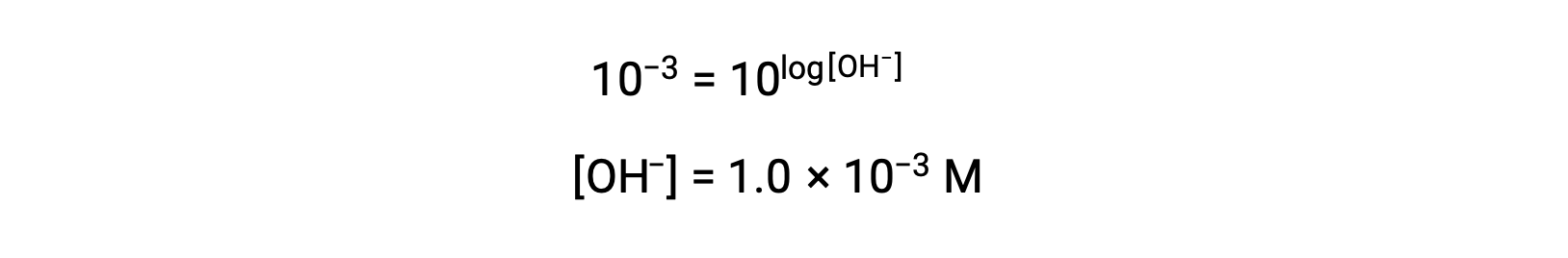Strong acids dissociate completely in water. For example, nitric acid dissociates completely into hydronium ions and nitrate ions. As the hydronium ions generated from the autoionization of water are negligible, the concentration of the hydronium ions in water is equal to the concentration of the strong acid. The pH of these solutions can be determined using the initial concentration of the strong acid. For example, in a 0.10 molar HCl solution, HCl will dissociate completely into the hydronium ions and chloride ions, and therefore the hydronium ion concentration of the solution will also be 0.10 molar. By taking the negative logarithm of this concentration, the pH of the solution is equal to one. Conversely, the pH of a solution can be used to determine the hydronium ion concentration of a solution. For example, for a solution of pH 3.60, its hydronium ion concentration can be determined by solving the equation 3.60 is equal to the negative log of the hydronium ion concentration. To solve for the concentration, multiply both sides by negative one, and then take the antilog of both sides. The hydronium ion concentration equals 2.5 times ten to the negative four molar. Strong bases that are group one metal hydroxides, like sodium hydroxide and potassium hydroxide, dissociate completely into solution. For example, 0.20 molar sodium hydroxide will dissociate completely in water and produce 0.20 molar sodium ions and 0.20 molar hydroxide ions. However, group two metal hydroxides, like barium hydroxide and calcium hydroxide, produce two moles of hydroxide ions for each mole of base. For example, 0.020 molar calcium hydroxide will dissociate completely in water and will produce 0.020 molar calcium ions and 0.040 molar hydroxide ions. Ionic metal oxides, like sodium oxide and calcium oxide, are also strong bases. Their oxide ion reacts with water and produces hydroxide ions. The concentration of hydroxide ions can be used to calculate a pOH and pH of the solution. For example, a five times ten to the negative five molar potassium hydroxide solution has an equal amount of hydroxide ions as strong base and therefore has a pOH of 4.30. Like pH, a pOH of the solution can also be used to determine hydroxide ion concentration by solving the equation: pOH equals the negative log of the hydroxide ion concentration. Since pH plus pOH is equal to 14 and the pOH is 4.3, the pH of the solution is 9.7.