15.6:
Soluzioni forti di acidi e basi
15.6:
Soluzioni forti di acidi e basi
Un acido forte è un composto che si dissocia completamente in una soluzione acquosa e produce una concentrazione di ioni idronio pari alla concentrazione iniziale di acido. Ad esempio, 0,20 M di acido idrobromico si dissociano completamente in acqua e producono 0,20 M di ioni idronio e 0,20 M di ioni bromuro.

D’altra parte, una base forte è un composto che si dissocia completamente in una soluzione acquosa e produce ioni idrossido. Ad esempio, 0,015 M KOH, un idrossido metallico di gruppo 1, si dissocia completamente e produce 0,015 M di OH– e 0,015 M di K+.
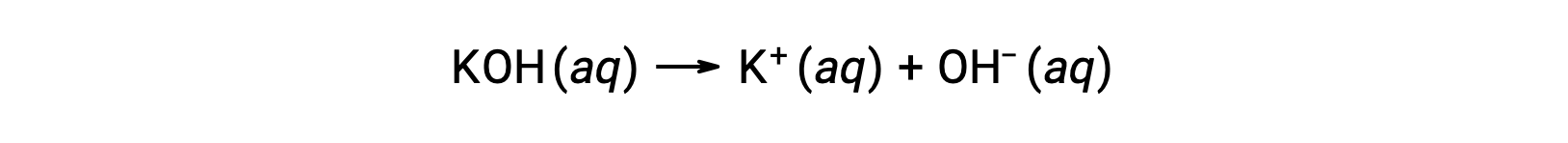
Gli idrossidi metallici del gruppo 2, come l’idrossido di bario [Ba(OH)2] e l’idrossido di stronzio [Sr(OH)2], sono anche basi forti e possiedono due ioni idrossido. Ciò li fa produrre una soluzione più semplice rispetto a NaOH o KOH alla stessa concentrazione. Ad esempio, 0,015 M Ba(OH)2 produce idrossido 0,015 M Ba+ e 0,030 M.
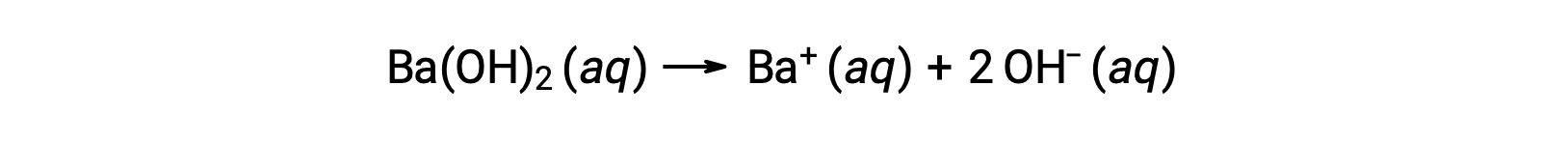
Poiché acidi e basi forti si dissociano completamente, i rapporti molari possono essere utilizzati per determinare le loro concentrazioni di idronio e idrossido, che a loro volta possono essere utilizzate per calcolare il pH o il pOH di una soluzione. Ad esempio, una soluzione HCl da 0,030 M produrrà ioni idronio da 0,03 M. Pertanto il pH di questa soluzione sarà

Il pOH della stessa soluzione può essere determinato utilizzando la formula
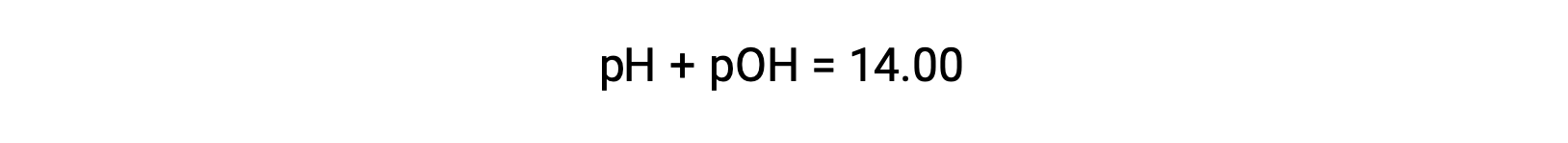
Poiché il pH della soluzione è 1,52, il suo pOH può essere calcolato come

Allo stesso modo, la concentrazione di ioni idrossido prodotti da basi forti può essere utilizzata per determinare il pOH di una soluzione usando l’equazione
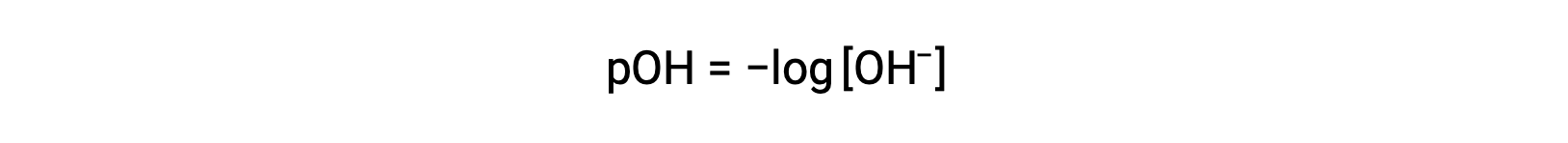
L’equazione precedente può anche essere usata per determinare la concentrazione di ioni idrossido quando il pOH è noto. Ad esempio, se il pOH di una soluzione è 3,00,
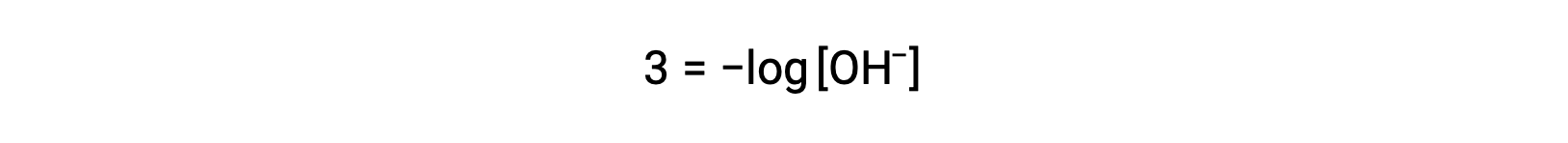
La moltiplicazione di entrambi i lati per −1 dà
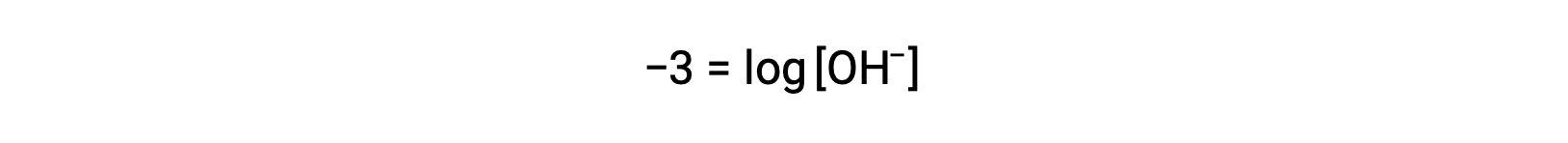
Ora, prendi l’antilogo di entrambe le parti
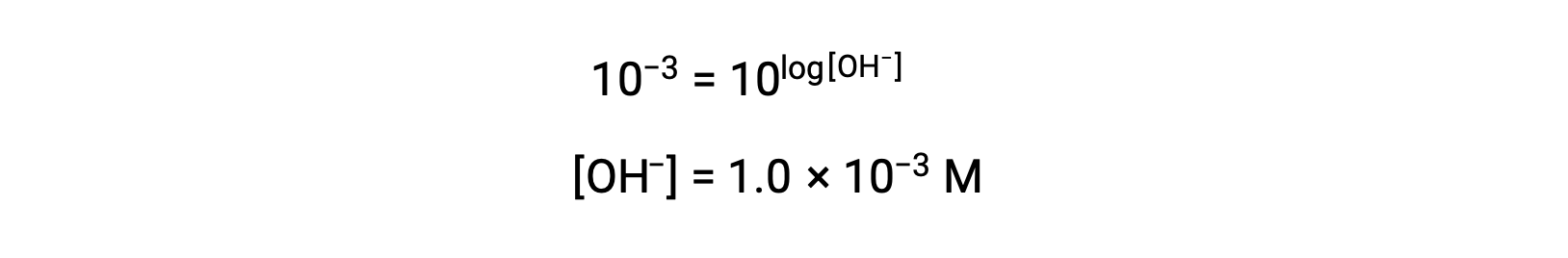
Pertanto, la concentrazione di ioni idronio della soluzione con pOH 3 è di 1,0 × 10−3 M. Un metodo simile può essere utilizzato per determinare la concentrazione di ioni idronio di una soluzione se il suo pH è noto.
