15.7:
المحاليل الحامضية الضعيفة
15.7:
المحاليل الحامضية الضعيفة
القليل من المركبات تعمل كأحماض قوية. يتصرف عدد أكبر بكثير من المركبات كأحماض ضعيفة وتتفاعل جزئيًا فقط مع الماء ، تاركة أغلبية كبيرة من الجزيئات المذابة في شكلها الأصلي وتولد كمية صغيرة نسبيًا من أيونات الهيدرونيوم. توجد الأحماض الضعيفة بشكل شائع في الطبيعة ، كونها المواد المسؤولة جزئيًا عن الطعم المنعش للحمضيات ، والإحساس اللاذع لدغات الحشرات ، والروائح الكريهة المرتبطة برائحة الجسم. مثال مألوف للحمض الضعيف هو حمض الأسيتيك ، المكون الرئيسي في الخل:

يشير استخدام السهم المزدوج في المعادلة أعلاه إلى جانب التفاعل الجزئي لهذه العملية. عند إذابته في الماء في ظل ظروف نموذجية ، يوجد حوالي 1٪ فقط من جزيئات حمض الأسيتيك في الصورة المتأينة ، CH 3 COO & # 8722؛ .
حساب تراكيز أيونات الهيدرونيوم ودرجة الحموضة لـ & # 160 ؛ محلول حمض ضعيف
حمض الفورميك ، HCO 2 H ، هو أحد المهيجات التي تسبب رد فعل الجسم لبعض لدغات ولسعات النمل. ما هو تركيز أيون الهيدرونيوم ودرجة الحموضة لمحلول 0.534-M من حمض الفورميك؟

جدول ICE لهذا النظام هو
| HCO2H (aq) | H3O+ (aq) | HCO2− (aq) | |
| التركيز الأولي (M) | 0.534 | ~0 | 0 |
| Change (M) | −x | +x | +x |
| تركيز التوازن (M) | 0.534 − x | x | x |
استبدال شروط تركيز التوازن في التعبير Ka يعطي
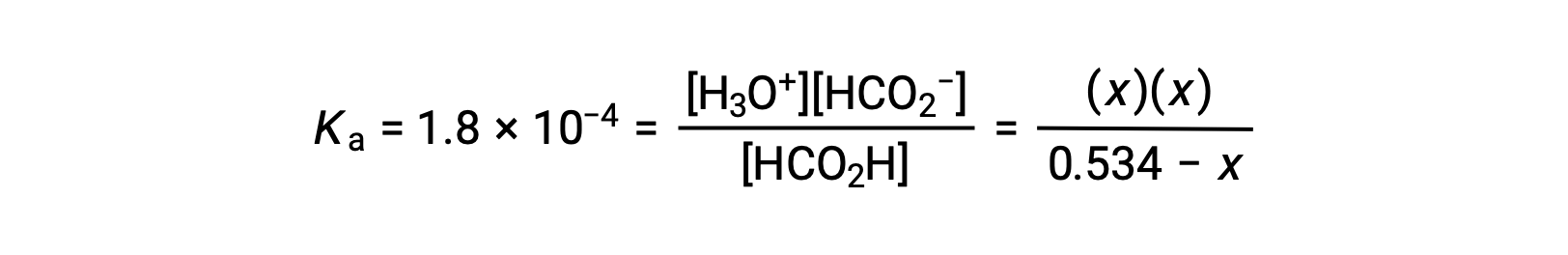
يسمح التركيز الأولي الكبير نسبيًا وثابت التوازن الصغير بافتراض تبسيط أن x ستكون أقل بكثير من 0.534، وبالتالي تصبح المعادلة
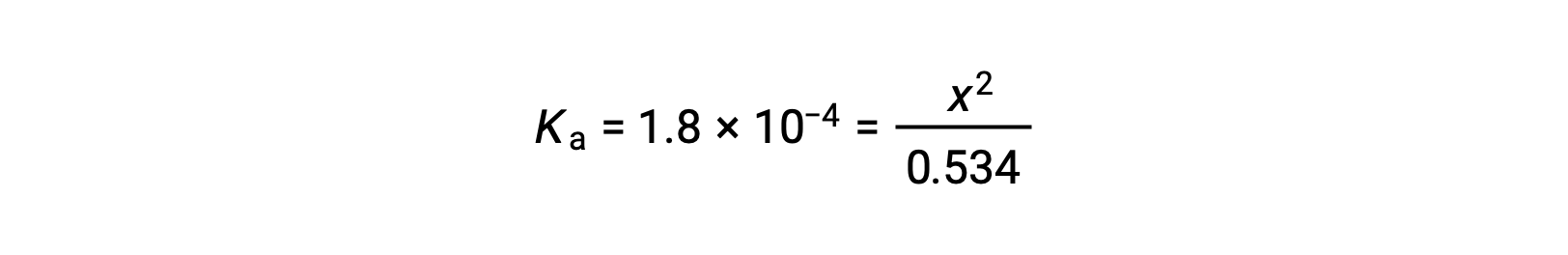
حل معادلة نواتج x
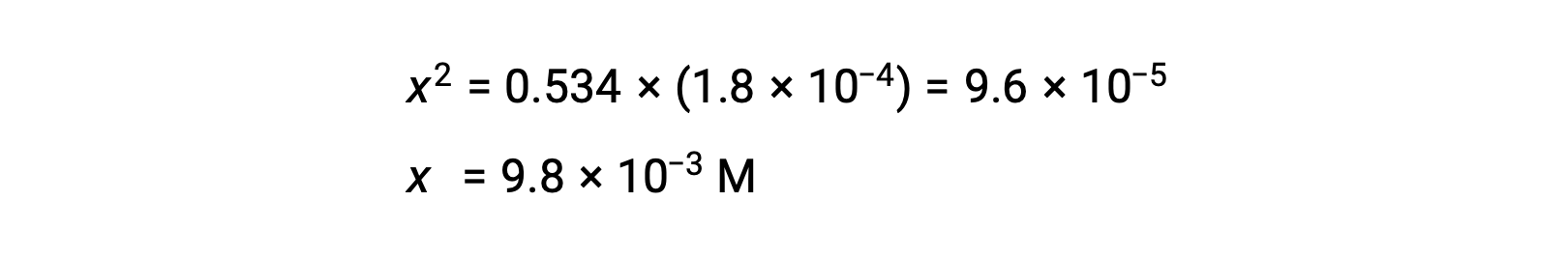
للتحقق من الافتراض القائل بأن x صغيرة مقارنة بـ 0.534 ، يمكن تقدير حجمها النسبي:
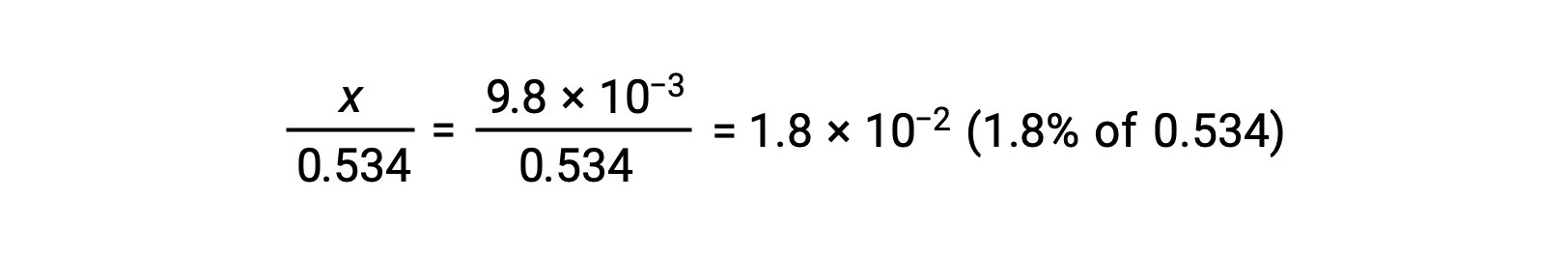
نظرًا لأن x أقل من 5٪ من التركيز الأولي، فإن الافتراض صحيح. كما هو محدد في جدول ICE، فإن x تساوي تركيز توازن أيون الهيدرونيوم:
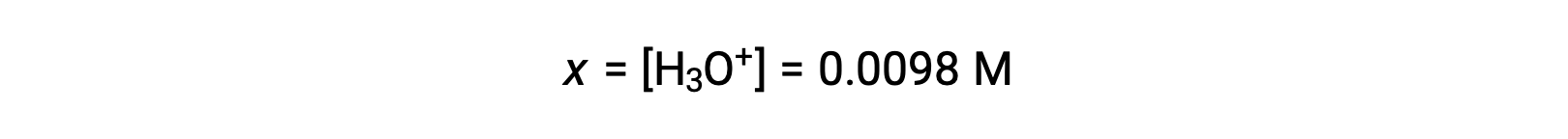
أخيرًا، يتم حساب الـ pH ليكون
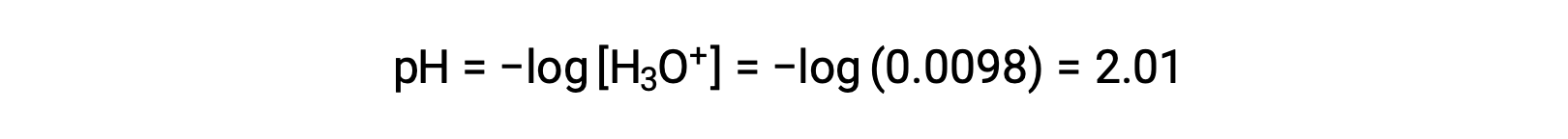
تحديد K a من الـ pH
الـ pH لمحلول 0.0516 M من حمض النيتروز، HNO2، هو 2.34. ما هو Ka؟
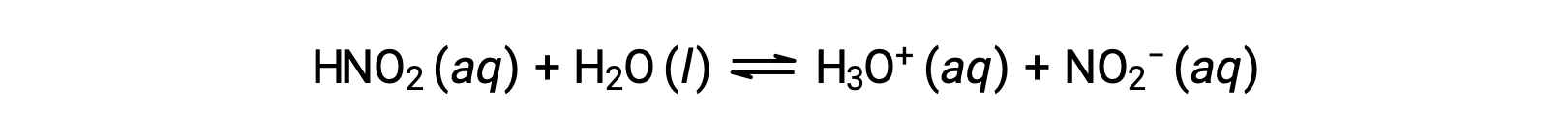
تركيز حمض النيتروز المقدم هو تركيز رسمي، وهو تركيز لا يأخذ في الحسبان أي توازن كيميائي قد ينشأ في المحلول. يتم التعامل مع هذه التركيزات على أنها “أولية” قيم حسابات التوازن باستخدام نهج جدول ICE. لاحظ أن القيمة الأولية لأيون الهيدرونيوم مُدرجة على أنها تقريباً صفر بسبب وجود تركيز صغير من H 3 O + (1 × 10−7 M) بسبب التأين التلقائي للمياه. في كثير من الحالات ، يكون هذا التركيز أقل بكثير من ذلك الناتج عن تأين الحمض (أو القاعدة) المعني وقد يتم إهماله.
الـ pH المقدم هو مقياس لوغاريتمي لتركيز أيون الهيدرونيوم الناتج عن التأين الحمضي لحمض النيتروز ، ولذا فهو يمثل “توازن” قيمة جدول ICE:

جدول ICE لهذا النظام هو بعد ذلك
| HNO2 (aq) | H3O+ (aq) | NO2− (aq) | |
| التركيز الأولي (M) | 0.0516 | ~0 | 0 |
| التغير في (M) | −0.0046 | +0.0046 | +0.0046 |
| تركيز التوازن (M) | 0.0470 | 0.0046 | 0.0046 |
أخيرًا، احسب قيمة ثابت التوازن باستخدام البيانات الموجودة في الجدول:
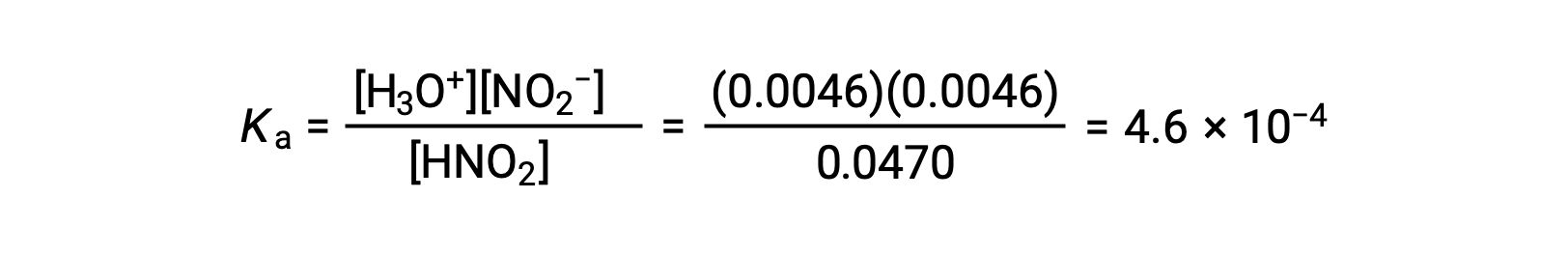
هذا النص مقتبس من Openstax, Chemistry 2e, Section 4.2: Classifying Chemical Reactions and Openstax, Chemistry 2e,14.3 Relative Strengths of Acids and Bases.
