15.7:
Растворы слабой кислоты
15.7:
Растворы слабой кислоты
Лишь немногие соединения действуют как сильные кислоты. Гораздо большее количество соединений ведут себя как слабые кислоты и лишь частично реагируют с водой, оставляя большое количество растворенных молекул в их первоначальном виде и генерируя относительно небольшое количество ионов гидрония. Слабые кислоты обычно встречаются в природе, будучи веществами, частично ответственными за тангеный вкус цитрусовых, жжение укусов насекомых, а также неприятные запахи, связанные с запахом тела. Знакомым примером слабой кислоты является уксусная кислота, основной ингредиент уксуса:
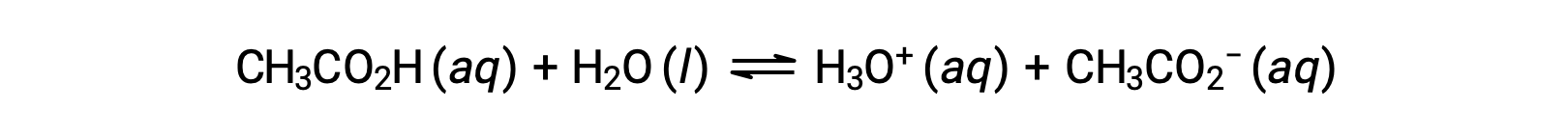
Использование двойной стрелки в приведенном выше уравнении обозначает аспект частичной реакции этого процесса. При растворении в воде в обычных условиях в ионизированной форме присутствует только около 1% молекул уксусной кислоты CH3COO.
Расчет концентрации ионов гидрония и pH слабой кислоты раствор
Формальная кислота, HCO2H, является одним раздражающим веществом, вызывающим реакцию организма на некоторые мутные укусы и стинги. Какова концентрация ионов гидрония и pH 0.534-M раствор формальной кислоты?
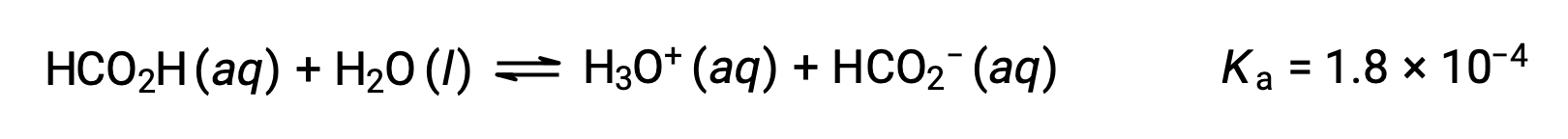
Таблица ICE для этой системы составляет
| HCO2H (Aq) | H3O+ (aq) | HCO2– (aq) | |
| Начальная концентрация (M) | 0.534 | ~0 | 0 |
| Изменение (M) | x | +x. | +x. |
| Равновесная концентрация (M) | 0.534 – x. | x | x |
Подстановка равновесных терминов концентрации в выражение Ka дает
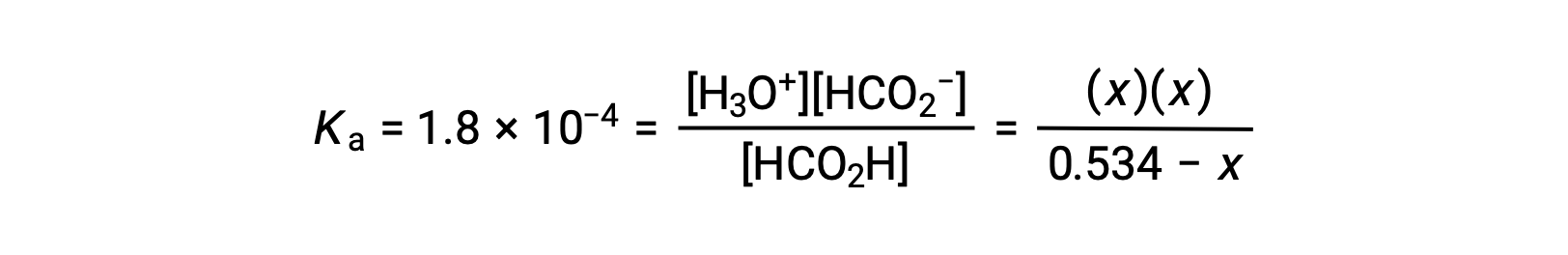
Относительно большая начальная концентрация и небольшая константа равновесия позволяют упростить предположение, что x будет значительно меньше 0.534, и таким образом уравнение становится
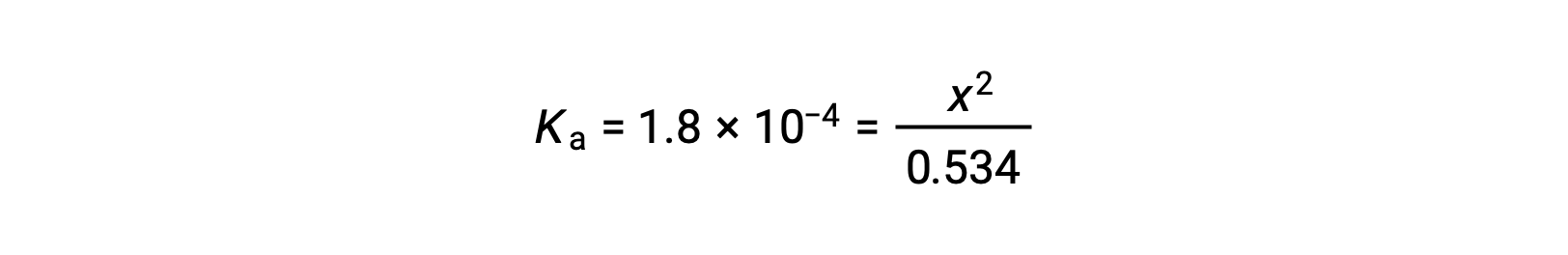
Решение уравнения для получения х урожаев
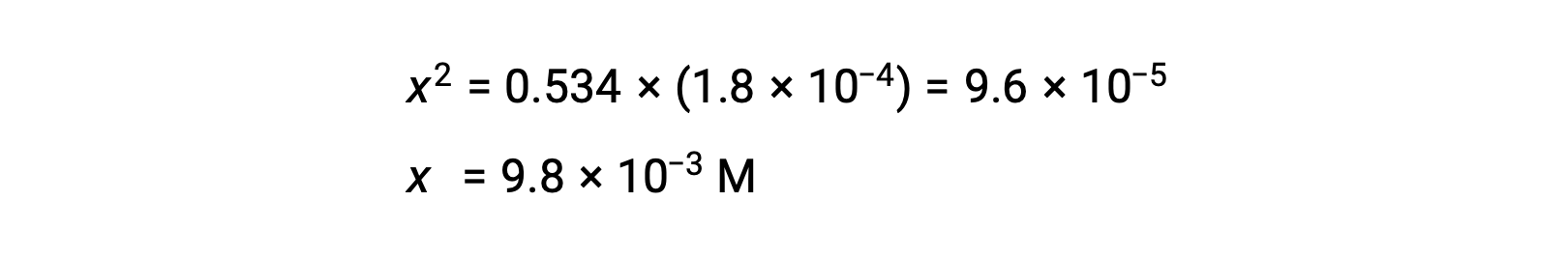
Чтобы проверить предположение, что x невелик по сравнению с 0.534, его относительную величину можно оценить:
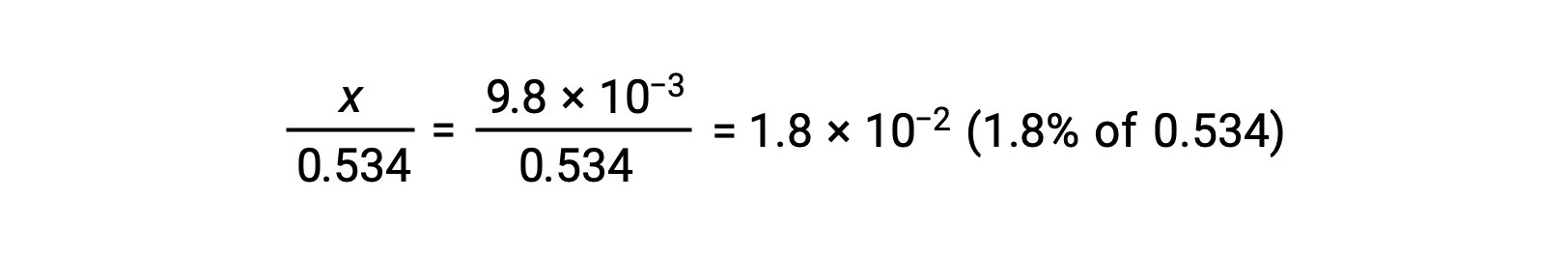
Поскольку x меньше 5% от начальной концентрации, предположение верно. Как определено в таблице ЛЬДА, x равно равновесной концентрации гидрония иона:
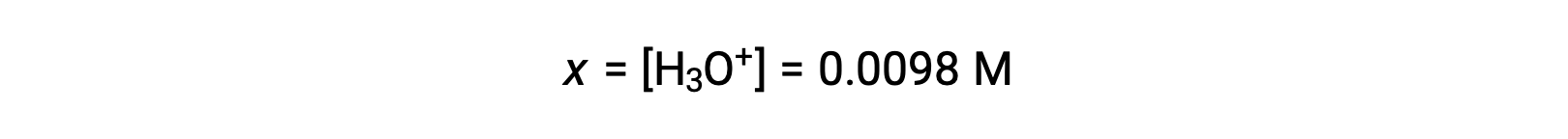
Наконец, рассчитывается pH
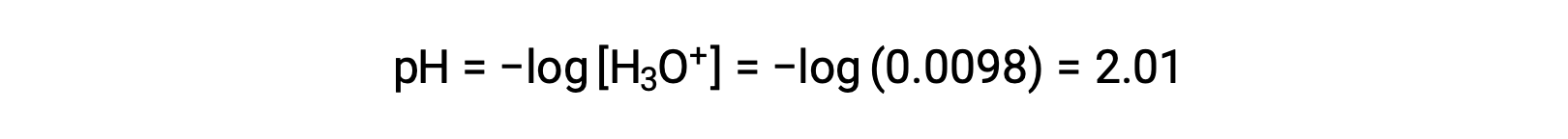
Определение Ка от рН
PH 0.0516 M раствор закиси азота, HNО2, составляет 2.34. Что такое Ка?
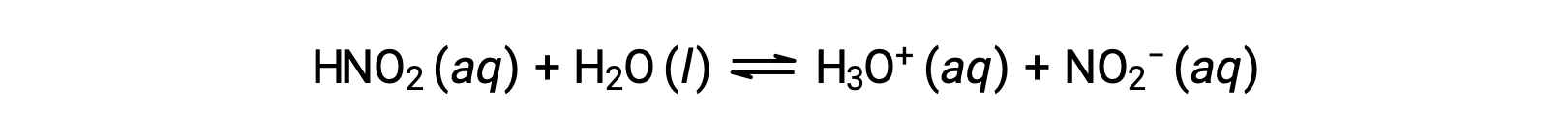
Концентрация закиси азота является формальной концентрацией, которая не учитывает никаких химических равновесий, которые могут быть установлены в раствор. Такие концентрации рассматриваются как “начальные” значения для расчетов равновесия с использованием таблицы ICE. Обратите внимание, что начальное значение иона гидрония указано как приблизительно нулевое, так как имеется небольшая концентрация H3O+ (1 × 10-7 M) из-за автоматической ионизации воды. Во многих случаях эта концентрация намного меньше, чем та, которая образуется при ионизации указанной кислоты (или основание), и ее можно игнорировать.
Полученный pH является логарифмической мерой концентрации ионов гидрония, полученной в результате кислотной ионизации зационной кислоты, и таким образом представляет собой «равновесное» значение для ледяной таблицы:
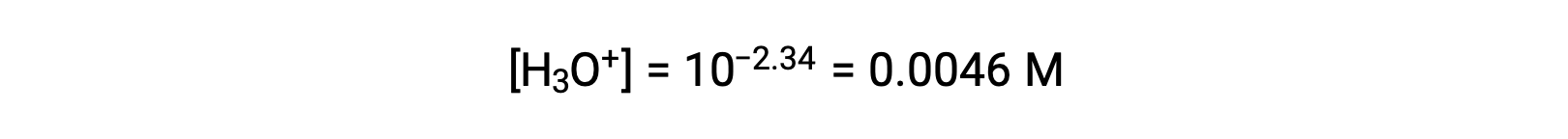
В этом случае таблица ICE для этой системы составляет
| HNО2 (aq) | H3O+ (aq) | NО2– (aq) | |
| Начальная концентрация (M) | 0.0516 | ~0 | 0 |
| Изменение (M) | 0.0046 | +0.0046 | +0.0046 |
| Равновесная концентрация (M) | 0.0470 | 0.0046 | 0.0046 |
Наконец, рассчитайте значение константы равновесия, используя данные в таблице:
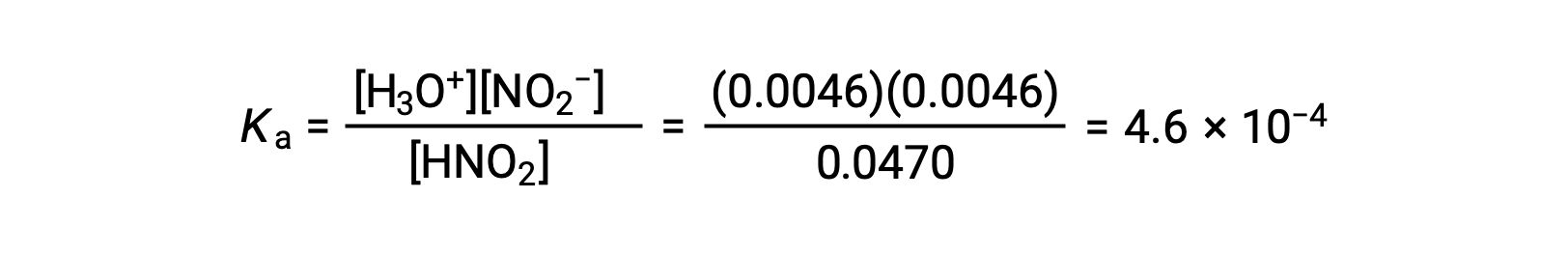
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 4.2: Классификация химических реакций и Openstax, Химия 2е изд.,14.3 относительные сильные стороны кислот и оснований.
