15.7:
Solutions d'acides faibles
15.7:
Solutions d'acides faibles
Peu de composés agissent comme des acides forts. Un nombre beaucoup plus élevé de composés se comportent comme des acides faibles et ne réagissent que partiellement avec l’eau, laissant une grande majorité de molécules dissoutes dans leur forme d’origine et générant une quantité relativement faible d’ions hydronium. Les acides faibles se trouvant généralement dans la nature, ce sont les substances en partie responsables du goût acidulé des agrumes, de la sensation de picotement des piqûres d’insectes, et des odeurs désagréables associées à l’odeur corporelle. L’acide acétique, principal ingrédient du vinaigre, est un exemple familier d’acide faible :
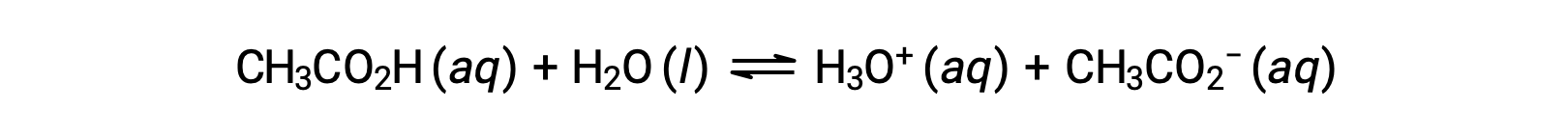
L’utilisation d’une double flèche dans l’équation ci-dessus indique l’aspect réaction partielle de ce processus. Lorsqu’elles sont dissoutes dans l’eau dans des conditions normales, seulement 1 % des molécules d’acide acétique sont présentes sous la forme ionisée, CH3COO−.
Calcul des concentrations en ions hydronium et du pH d’ une solution d’acide faible
L’acide formique, HCO2H, est un irritant qui provoque la réaction du corps à certaines morsures et piqûres de fourmis. Quelle est la concentration de l’ion hydronium et le pH d’une solution d’acide formique à 0,534 M ?
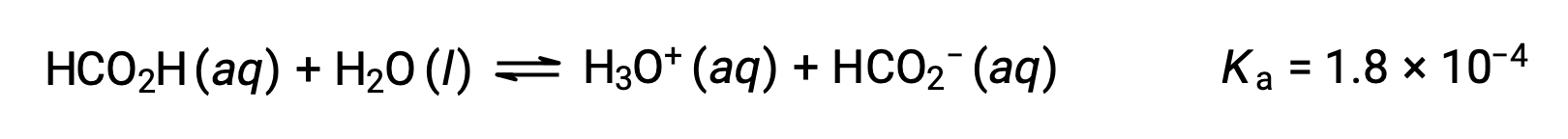
Le tableau ICE de ce système est
| HCO2H (aq) | H3O+ (aq) | HCO2− (aq) | |
| Concentration initiale (M) | 0,534 | ~0 | 0 |
| Changement (M) | −x | +x | +x |
| Concentration à l’équilibre (M) | 0,534 − x | x | x |
La substitution des termes de la concentration à l’équilibre dans l’expression de Ka donne
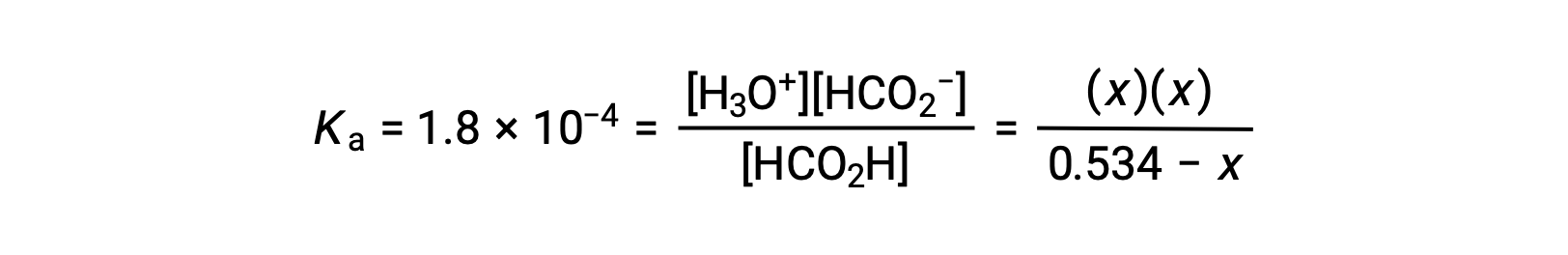
La concentration initiale relativement importante et la petite constante d’équilibre permettent pour simplifier de supposer que x sera beaucoup moins élevé que 0,534 et, ainsi, l’équation devient
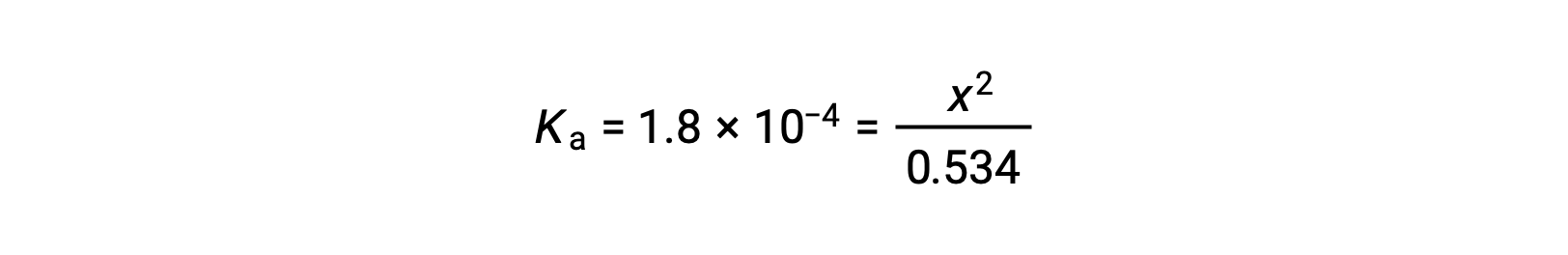
La résolution de l’équation pour déterminer x donne
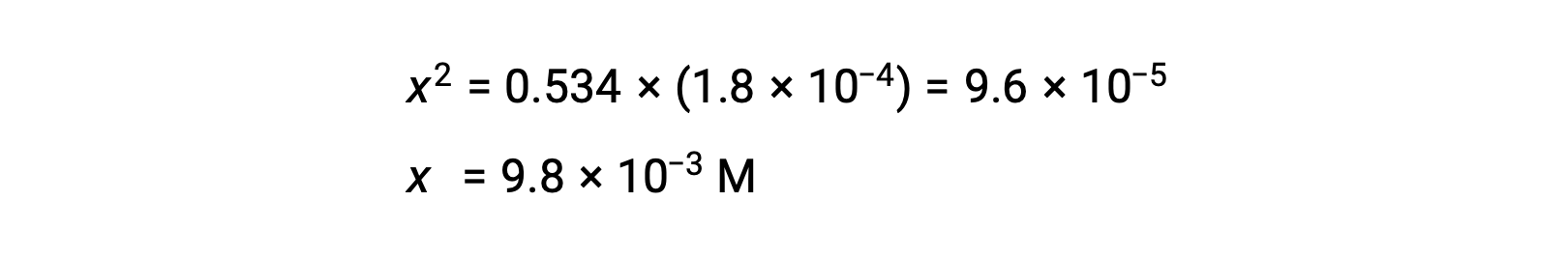
Il est possible d’estimer sa valeur absolue relative afin de vérifier la supposition que x est petit comparé à 0,534 :
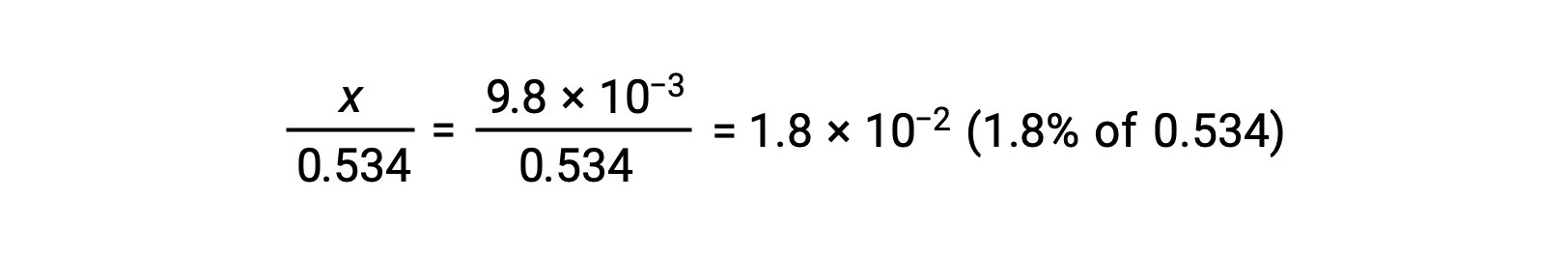
Étant donné que x est inférieur à 5 % de la concentration initiale, la supposition est valable. Comme défini dans le tableau ICE, x est égal à la concentration à l’équilibre de l’ion hydronium :
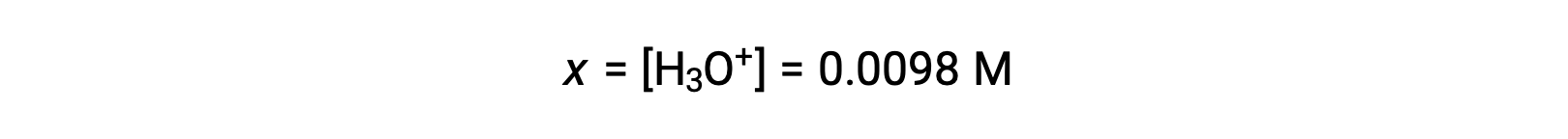
Enfin, le pH est calculé à
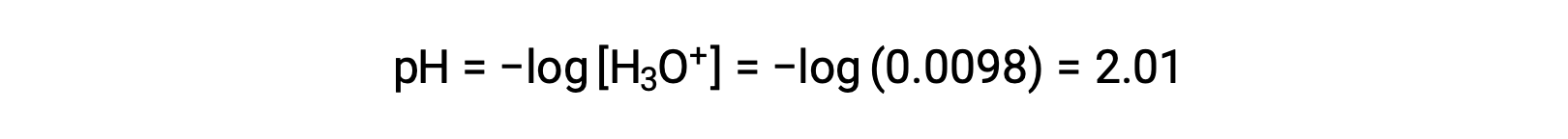
Détermination de Ka à partir du pH
Le pH d’une solution de 0,0516 M d’acide nitreux, HNO2, est de 2,34. Quel est son Ka ?
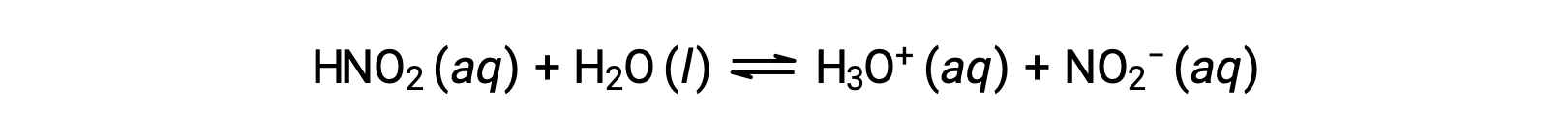
La concentration de l’acide nitreux fournie est une concentration formelle qui ne tient pas compte des équilibres chimiques qui peuvent être établis en solution. De telles concentrations sont traitées comme des valeurs “ initiales ” pour les calculs d’équilibre utilisant l’approche du tableau ICE. On remarque que la valeur initiale de l’ion hydronium est indiquée comme étant approximativement nulle, car une faible concentration de H3O+ est présente (1 × 10−7 M) en raison de l’auto-ionisation de l’eau. Dans de nombreux cas, cette concentration est beaucoup moins importante que celle générée par l’ionisation de l’acide (ou de la base) en question et peut être négligée.
Le pH fourni est une mesure logarithmique de la concentration en ions hydronium résultant de l’ionisation acide de l’acide nitreux et représente donc une valeur d’équilibre pour le tableau ICE :
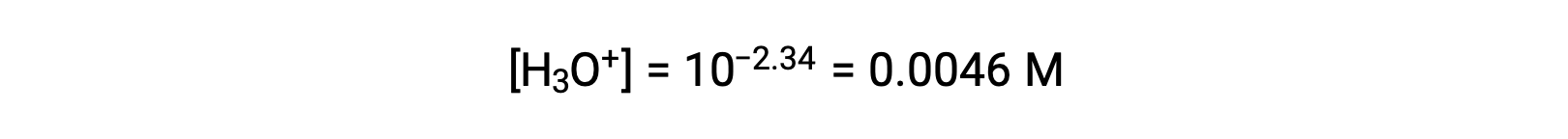
Le tableau ICE de ce système est alors
| HNO2 (aq) | H3O+ (aq) | NO2− (aq) | |
| Concentration initiale (M) | 0,0516 | ~0 | 0 |
| Changement (M) | −0,0046 | +0,0046 | +0,0046 |
| Concentration à l’équilibre (M) | 0,0470 | 0,0046 | 0,0046 |
Enfin, calculez la valeur de la constante d’équilibre à l’aide des données du tableau :
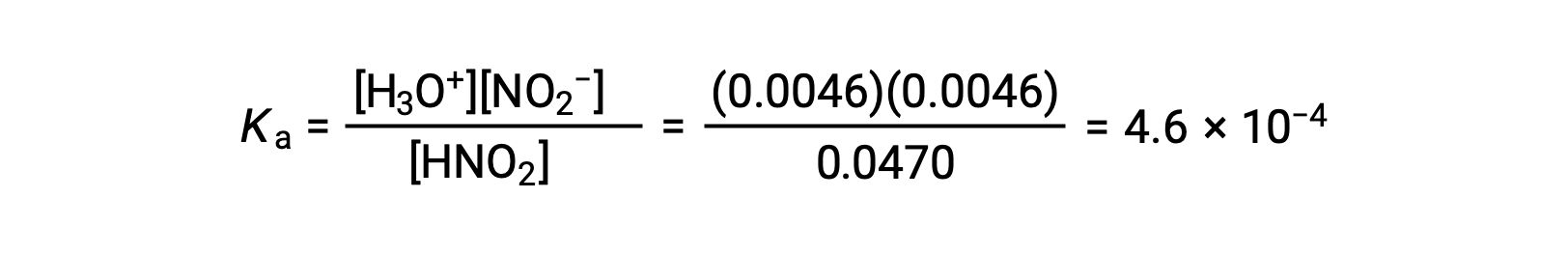
Ce texte est adapté de Openstax, Chimie 2e, Section 4.2 : Classifier les réactions chimiques et Openstax, Chimie 2e,14.3 Forces relatives des acides et des bases.
