15.8:
Растворы слабых оснований
15.8:
Растворы слабых оснований
Некоторые соединения производят ионы гидроксида при растворении химически реагируя с молекулами воды. Во всех случаях эти соединения реагируют только частично и так классифицируются как слабые основания. Эти типы соединений также изобилуют в природе и важных товарах в различных технологиях. Например, глобальное производство слабого аммиака основание, как правило, значительно превышает 100 метрических тонн в год, широко используется в качестве сельскохозяйственных удобрений, сырья для химического синтеза других соединений и активного ингредиента бытовых чистящих средств. При растворении в воде аммиак частично реагирует на ионы гидроксида, как показано ниже:
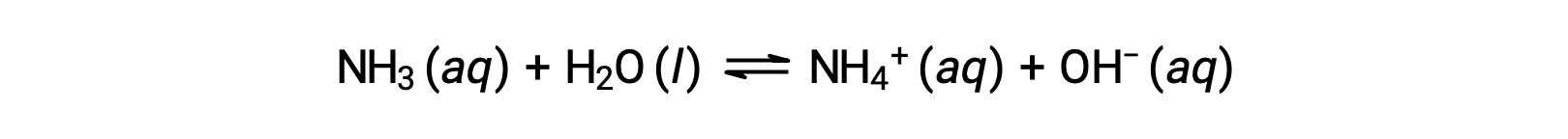
Это, по определению, реакция кислотно-основная, в данном случае включающая перенос ионов H+ из молекул воды в молекулы аммиака. В типичных условиях в качестве ионов NH4+ присутствует только около 1% растворенного аммиака.
Расчет концентраций ионов гидроксида и Poh в слабой основание раствор
Найдите концентрацию гидроксидного иона, пуха и pH 0.25 M раствор триметиламина, слабого основание:
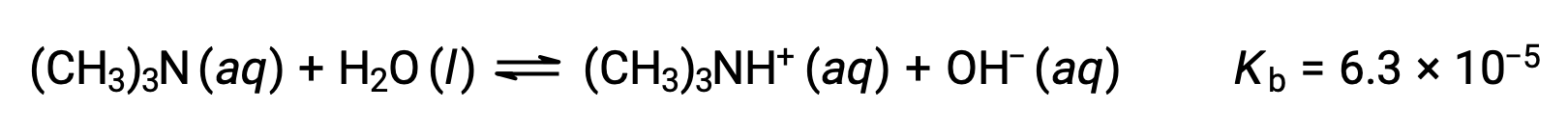
Таблица ICE для этой системы составляет
| (CH3)3N (aq) | (CH3)3NH+ (aq) | OH- (Aq) | |
| Начальная концентрация (M) | 0.25 | 0 | ~0 |
| Изменение (M) | x | +x. | +x. |
| Равновесная концентрация (M) | 0.25 – x. | 0 + x. | ~0 + x. |
Подстановка терминами равновесной концентрации в выражение Kb дает
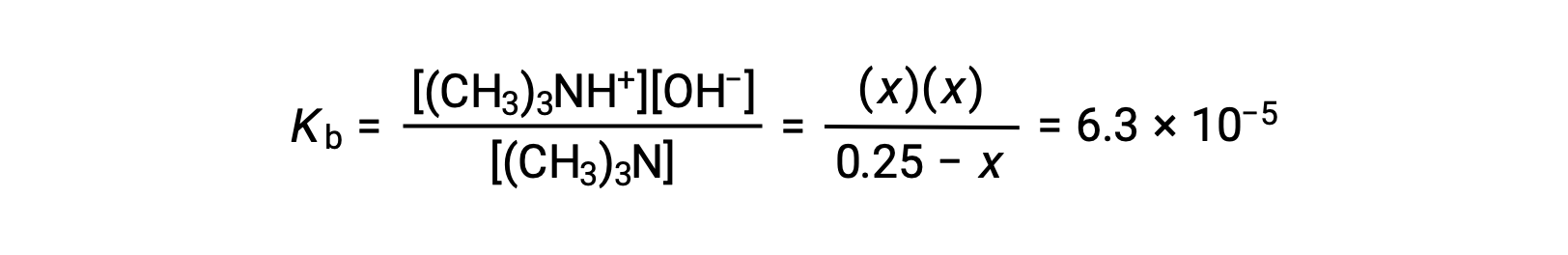
Предполагая x << 0.25 и решая для получения х урожаев
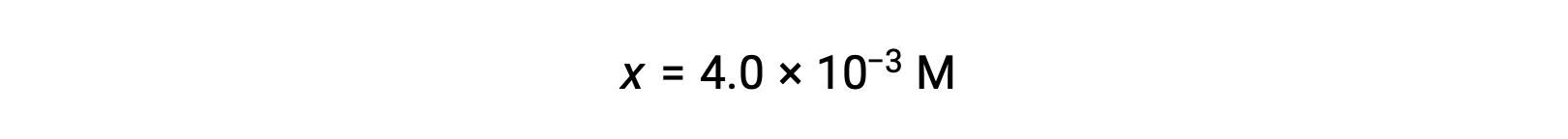
Это значение меньше 5% от начальной концентрации (0.25), поэтому предположение оправдано.
Как определено в таблице ЛЬДА, x равно равновесной концентрации гидроксидного иона:
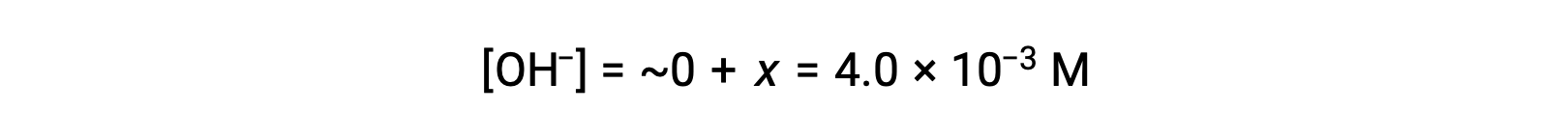
Расчетное значение PoH составляет
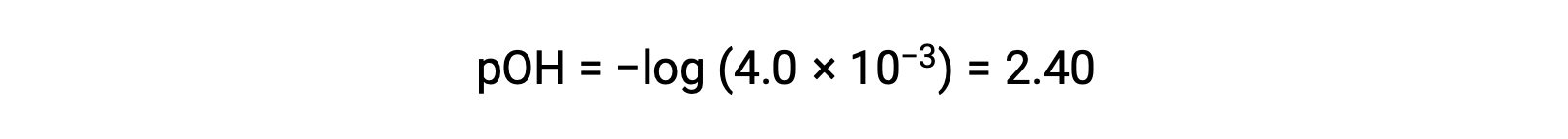
С помощью связи;
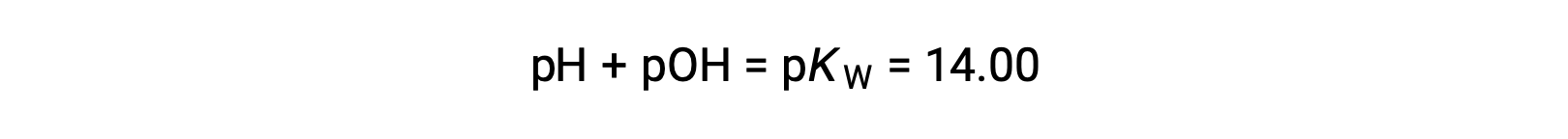
Позволяет вычислить pH:
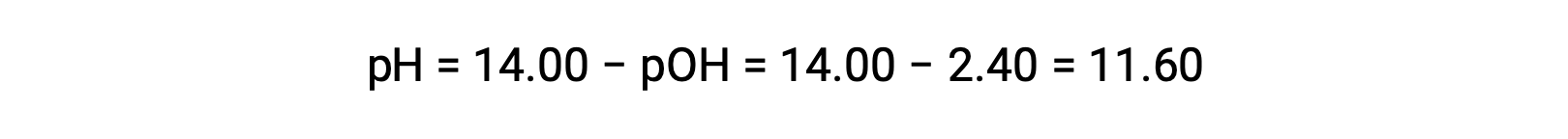
Определение Kb от pH
Если pH 0.28 M раствор этиламина (C2H5NH2) составляет 12.10, что это за Kb?
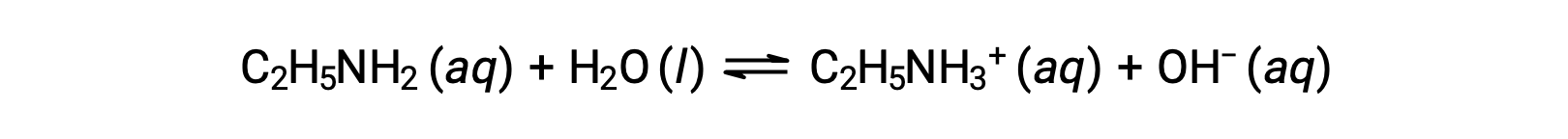
Для расчета Kb этиламина сначала необходимо определить концентрацию Poh и ионов гидроксида. Поскольку pH составляет 12.10, PoH можно рассчитать следующим образом:
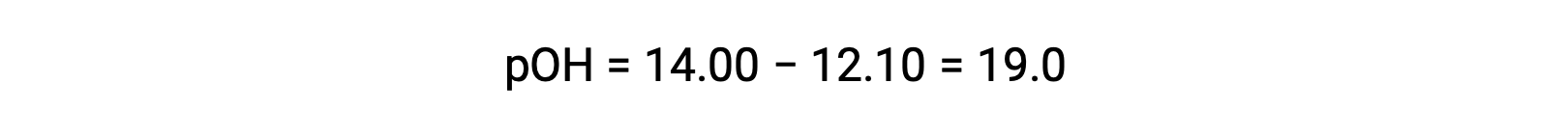
Поскольку Poh равно 1.90, концентрация ионов гидроксида раствор может быть вычислена по формуле
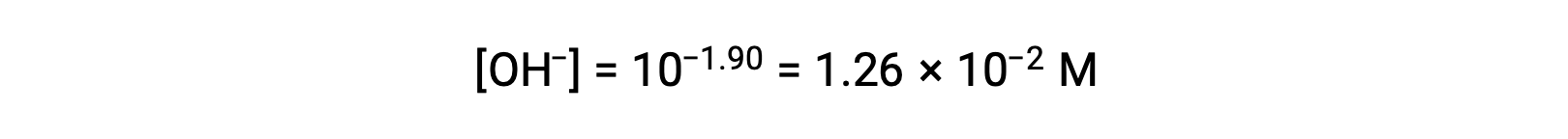
Для этой системы можно построить ледяной стол следующим образом
| C2H5NH2 (aq) | C2H5NH3+ (aq) | OH- (Aq) | |
| Начальная концентрация (M) | 0.28 | 0 | ~0 |
| Изменение (M) | 0.0126 | +0,0126 | +0,0126 |
| Равновесная концентрация (M) | 0.28 – 0.0126 | 0.0126 | 0.0126 |
Так как 0.0126 м составляет 4.5% от 0.28 м, 0.28 – 0.0126 можно считать почти равным 0.28 м по правилу 5%.
После подстановки указанных выше значений в выражении для Kb этиламина,
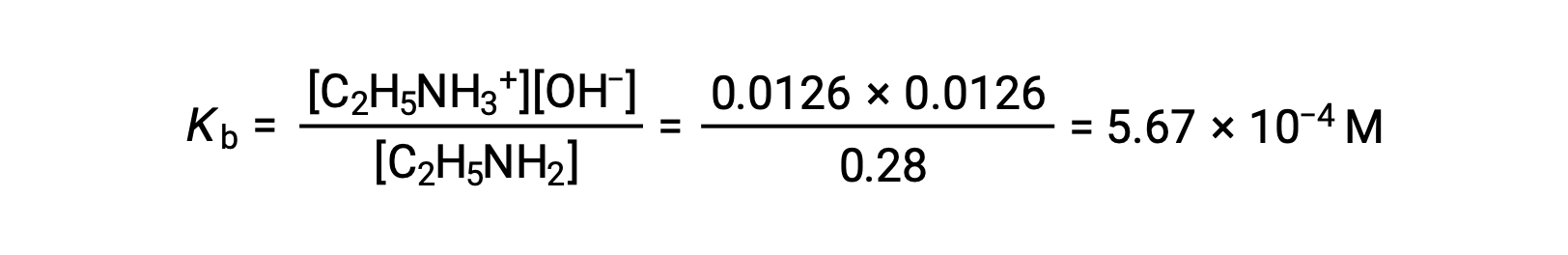
Этот текст адаптирован из Openstax, Химия 2е изд. раздел 4.2: Классификация химических реакций и 14.3 относительных сильных сторон кислот и оснований.
