15.8:
Soluciones de Bases Débiles
15.8:
Soluciones de Bases Débiles
Algunos compuestos producen iones hidróxido cuando se disuelven reaccionando químicamente con moléculas de agua. En todos los casos, estos compuestos reaccionan sólo parcialmente y por lo tanto se clasifican como bases débiles. Este tipo de compuestos son también abundantes en la naturaleza y son productos básicos importantes en diversas tecnologías. Por ejemplo, la producción mundial de la base débil amoníaco suele ser más de 100 toneladas métricas al año, siendo ampliamente utilizada como fertilizante agrícola, una materia prima para la síntesis química de otros compuestos y un ingrediente activo en los limpiadores domésticos. Cuando se disuelve en agua, el amoníaco reacciona parcialmente para producir iones hidróxido, como se muestra a continuación:
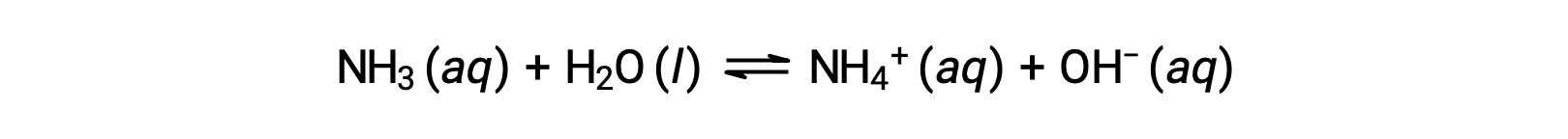
Esta es, por definición, una reacción ácido-base, en este caso implicando la transferencia de iones H+ de las moléculas de agua a las moléculas de amoníaco. En condiciones normales, sólo alrededor del 1% del amoníaco disuelto está presente como iones NH4+.
Cálculo de las concentraciones de iones hidróxido y del pOH en una solución de base débil
Encontrar la concentración de ion hidróxido, el pOH y el pH de una solución 0,25 M de trimetilamina, una base débil:
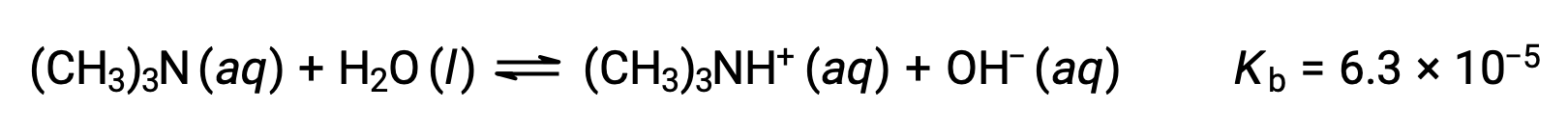
La tabla ICE para este sistema es
| (CH3)3N (ac) | (CH3)3NH+ (ac) | OH− (ac) | |
| Concentración inicial (M) | 0,25 | 0 | ~0 |
| Cambio (M) | − x | +x | +x |
| Concentración de equilibrio (M) | 0,25 − x | 0 + x | ~0 + x |
Al sustituir los términos de concentración de equilibrio en la expresión Kb queda
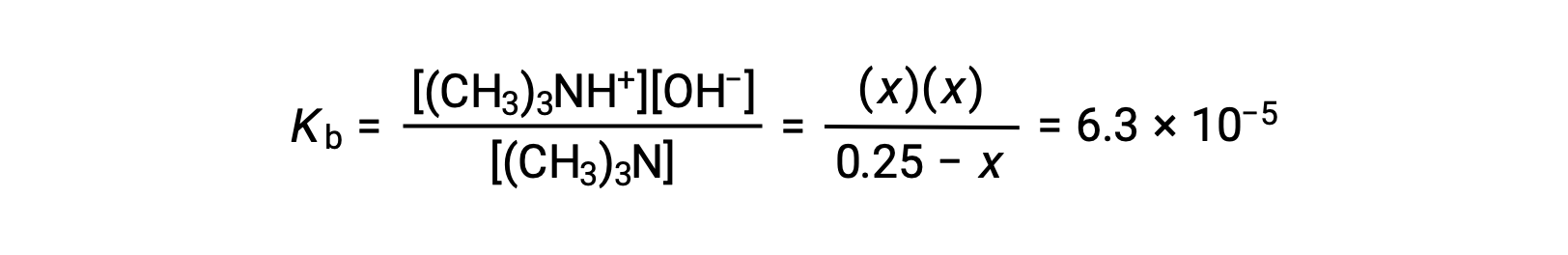
Asumiendo que x << 0,25 y resolviendo x se obtiene
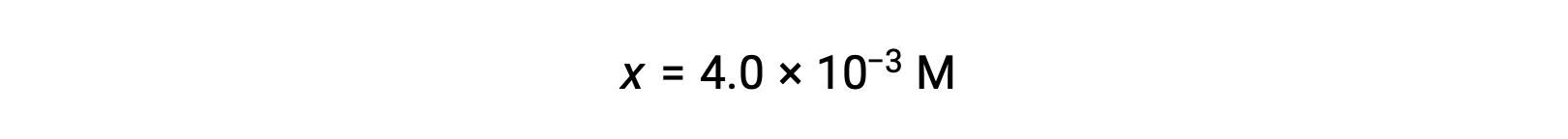
Este valor es inferior al 5% de la concentración inicial (0,25), por lo que la suposición está justificada.
Como se define en la tabla ICE, x es igual a la concentración de equilibrio del ión hidróxido:
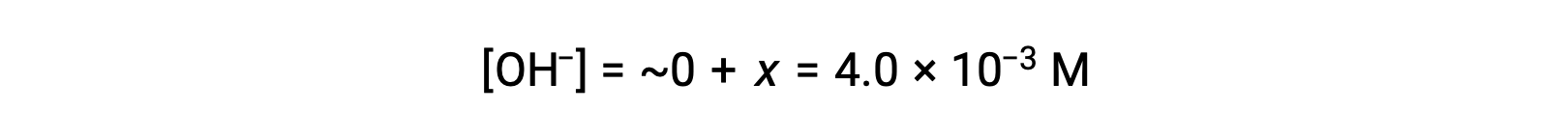
El pOH se calcula que es
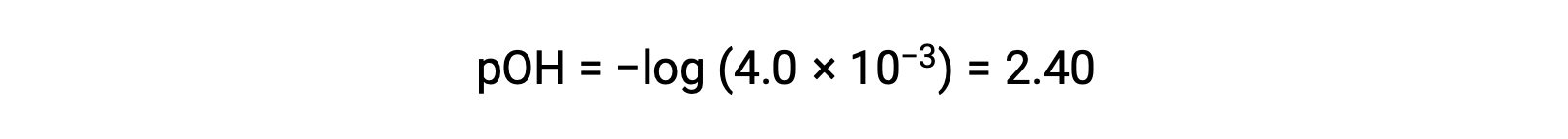
Utilizar la relación;
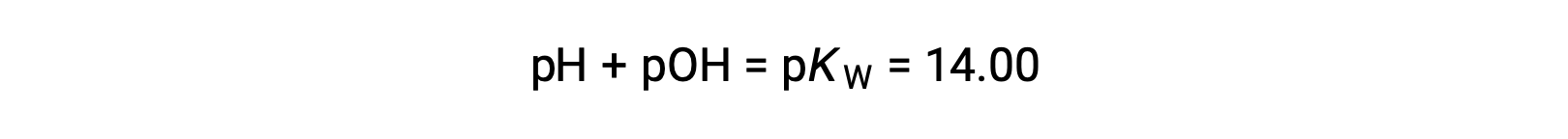
permite el cálculo del pH:
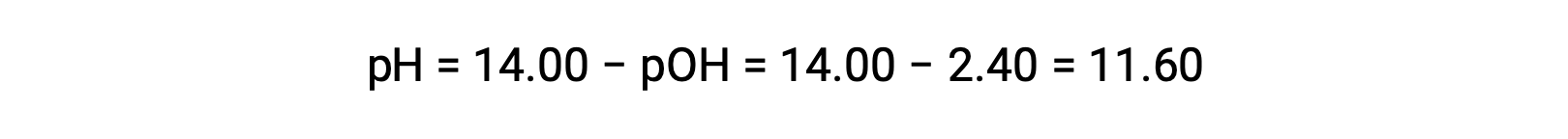
Determinación de Kb a partir del pH
Si el pH de la solución de etilamina 0,28 M (C2H5NH2) es 12,10, ¿cuále es su Kb?
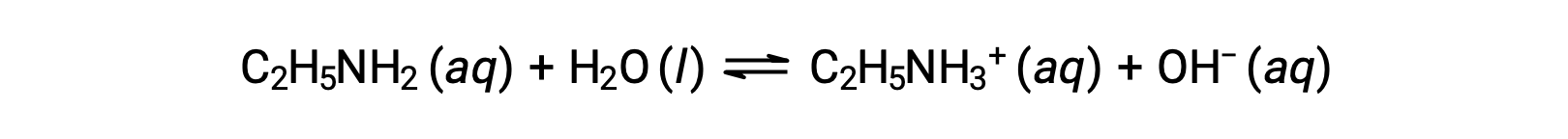
Para calcular el Kb de la etilamina, es necesario determinar primero la concentración de iones hidróxido y el pOH. Como el pH es 12,10, el pOH se puede calcular de la siguiente manera:

Como la pOH es 1,90, la concentración de iones hidróxido de la solución puede calcularse utilizando la fórmula
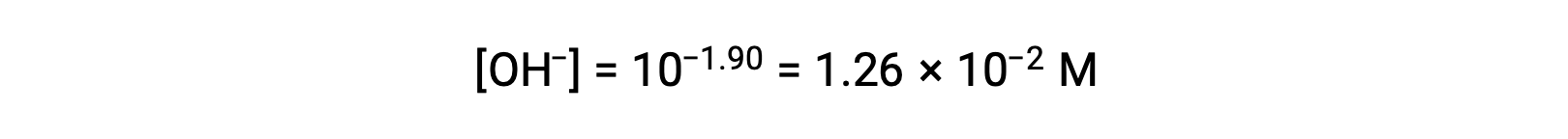
La tabla ICE para este sistema se puede construir de la siguiente manera
| C2H5NH2 (ac) | C2H5NH3+ (ac) | OH− (ac) | |
| Concentración inicial(M) | 0,28 | 0 | ~0 |
| Cambio(M) | −0,0126 | +0.0126 | +0.0126 |
| Concentración de equilibrio(M) | 0,28 − 0,0126 | 0,0126 | 0,0126 |
Como el 0,0126 M es el 4,5% de 0,28 M, 0,28 − 0,0126 puede considerarse casi igual a 0,28 M por la regla del 5%.
Después de sustituir los valores anteriores en la expresión por el Kb de la etilamina,
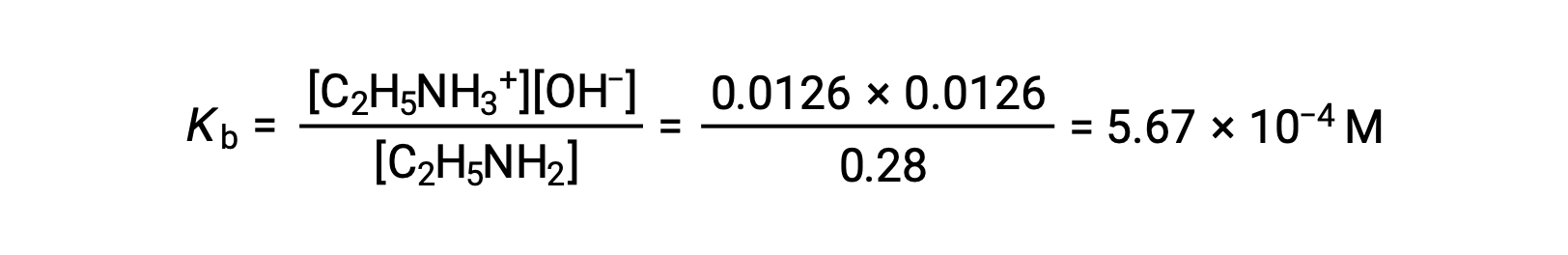
Este texto es adaptado de Openstax, Química 2e Sección 4.2: Clasificación de las Reacciones Químicas y 14.3 Fuerzas Relativas de Ácidos y Bases.
