15.10:
离子作为酸和碱
15.10:
离子作为酸和碱
含酸性离子的盐类
盐类是由阳离子和阴离子组成的离子化合物,其中一种可能能够与水发生酸或碱电离反应。 因此,水性盐溶液可能是酸性,碱性或中性的, 取决于盐组成离子的相对 酸-碱 强度。 例如,在水中溶解氯化铵会产生离解,如方程所述:
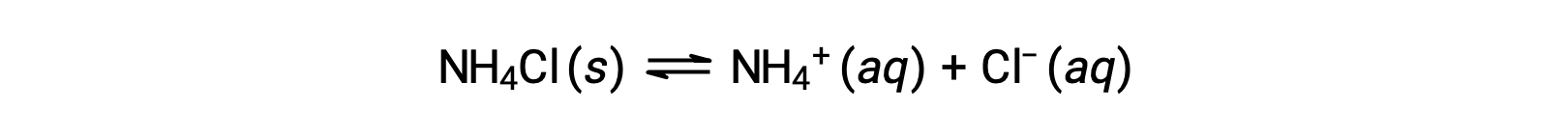
铵离子是碱氨的共轭酸, NH3 ;其酸离子化 (或酸性水解) 反应由表示
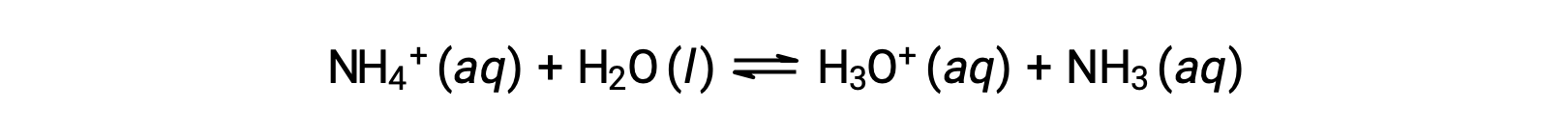
由于氨是弱碱,KB 是可测量的,Ka > 0 (铵离子是弱酸)。
氯化离子是盐酸的共轭碱,因此其碱离子化 (或碱水解) 反应由表示
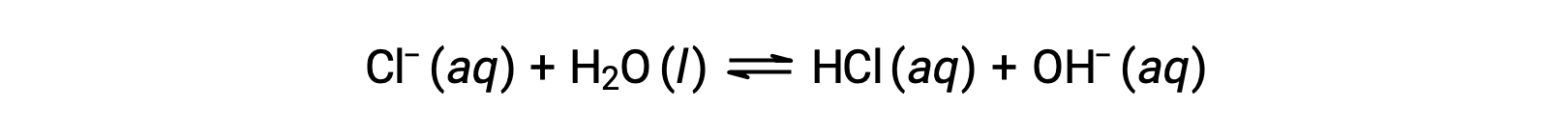
由于 HCL 是一种强酸,Ka 的大小无法测量, KB ≈ 0 (氯化离子不会发生明显的水解)。 因此,水中溶解氯化铵产生一个弱酸阳离子 (NH4+) 和惰性阴离子 (CL−) 的溶液,形成酸性溶液。
含基本离子的盐类
另一个例子是,考虑在水中溶解乙酸钠:
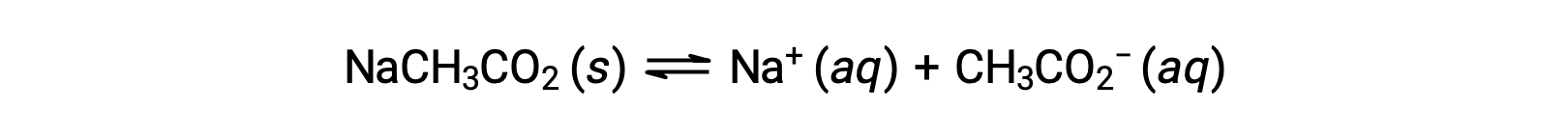
该钠离子不会发生明显的酸或碱电离,对溶液 pH 没有影响。 从离子的公式中可以看出这一点,该公式表示没有氢或氧原子,但如本节后面所述,一些溶解金属离子起着弱酸的作用。 醋酸离子 CH3CO2− 是乙酸的共轭碱, CH3CO2H,因此其碱电离 (或碱水解) 反应由表示
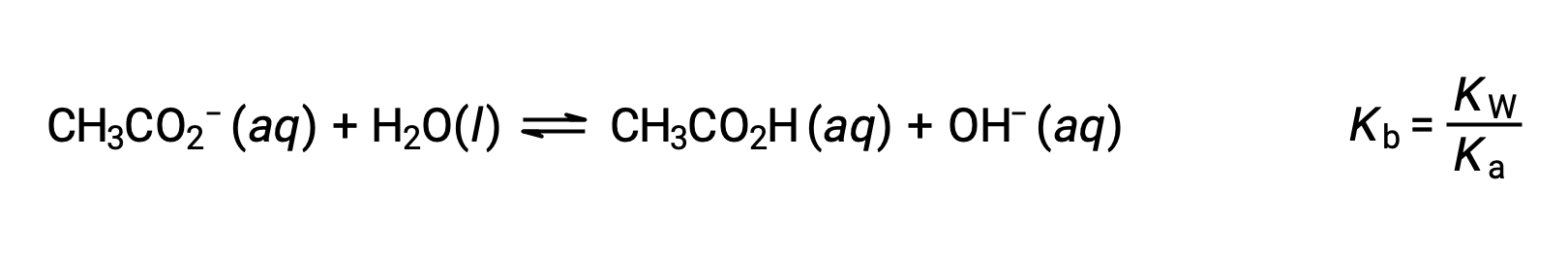
因为乙酸是一种弱酸,其Ka 是可测量的, KB > 0 (乙酸离子是一种弱碱)。 在水中溶解乙酸钠可产生溶液的惰性阳离子 (Na+) 和弱碱阴离子 (CH3CO2−) ,从而产生基本的溶液。
含酸性和基本离子的盐类
一些盐由酸性和基本离子组成,因此其溶液的 pH 值将取决于这两种物质的相对强度。 对于这类盐类,通过比较Ka 和 KB 值可以预测溶液的 酸-碱 状态。
水合金属离子的电离
与上述示例的 1 组和 2 组金属离子 (Na+ , Ca2+ 等) 不同,一些金属离子在水溶液中起着酸作用。 这些离子不仅仅是在溶解时由水分子散解溶剂化;而是对固定数量的水分子进行共价结合的以产率 A 错合离子 (参见配位化学一章)。 例如,水中硝酸铝的溶解通常表示为

然而,铝 (III) 离子实际上与六个水分子发生反应,形成稳定的错合离子,因此溶解过程的更明确的表现是
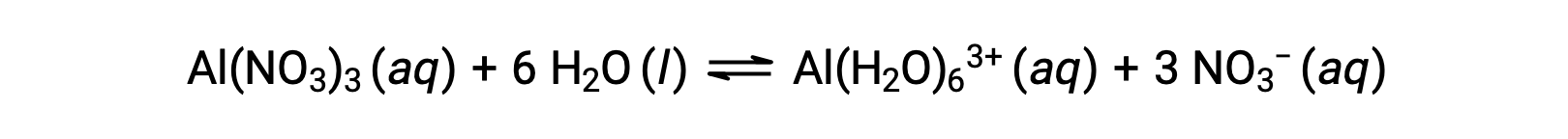
Al (H2O) 63 + 离子涉及一个中心 Al 原子和六个水分子的 O 原子之间的键。 因此,键合水分子的 O – H 键的极性高于非粘结水分子,使键合分子更容易捐献氢离子:
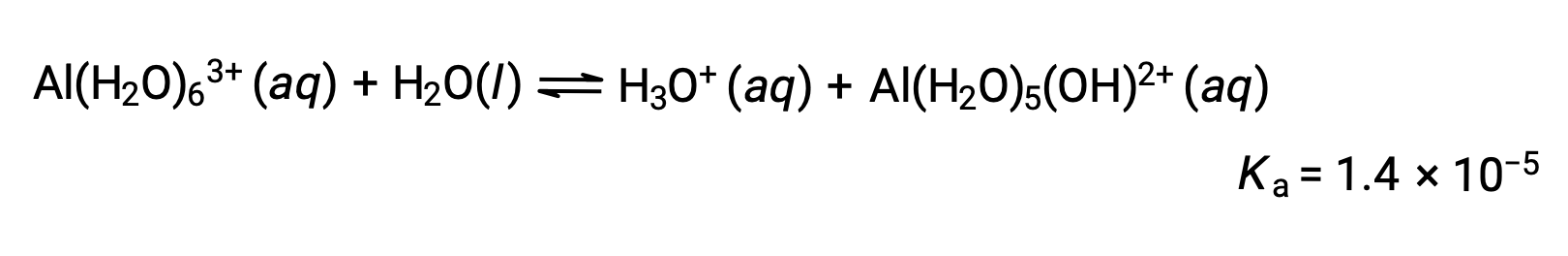
该过程产生的共轭碱包含五个其他键合水分子,它们能够充当酸,因此质子的连续或逐步转移是可能的,如下几个方程式所示:
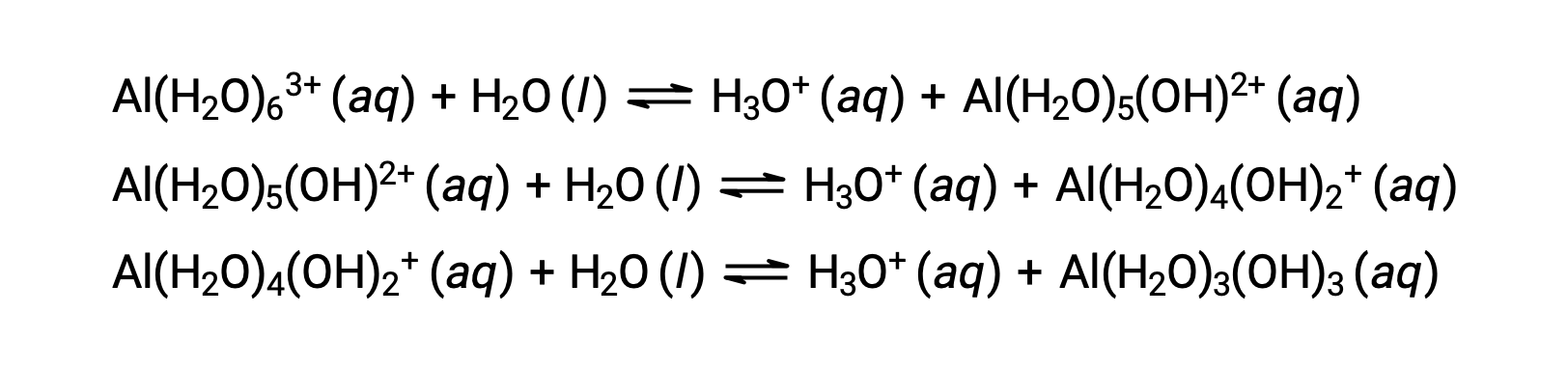
除碱金属 (1 类) 和一些碱性地金属 (2 类) 外,当溶解在水中时,大多数其他金属离子将在一定程度上发生酸离子化。 这些错合离子的酸强通常会随着电荷增加和金属离子尺寸减小而增加。 其他几种酸性金属离子的第一步酸离子化方程如下所示:
| 第一步电离方程 | pKa |
| Fe(H2O)63+ (aq) + H2O (l) ⇌ H3O+ (aq) + Fe(H2O)5(OH)2+ (aq) | 2.74 |
| Cu(H2O)62+ (aq) + H2O (l) ⇌ H3O+ (aq) + Cu(H2O)5(OH)+ (aq) | ~6.3 |
| Zn(H2O)42+ (aq) + H2O (l) ⇌ H3O+ (aq) + Zn(H2O)3(OH)+ (aq) | 9.6 |
本文改编自 Openstax, 化学 2e, 第14.4节:盐的水解。
